
| A. | Fe | B. | Co | C. | Mn | D. | Ni |
科目:高中化学 来源: 题型:选择题
| A. | 氯化铁溶液与碘化钾溶液反应:Fe3++2I-═Fe2++I2 | |
| B. | 硫酸溶液与氢氧化钡溶液反应:Ba2++SO42-═BaSO4↓ | |
| C. | 醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+═Ca2++H2O+CO2↑ | |
| D. | 氯化镁溶液与过量氨水反应:Mg2++2NH3•H2O═Mg (OH)2↓+2NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
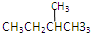 和
和
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 3:2 | B. | 1:3 | C. | 1:8 | D. | 2:5 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
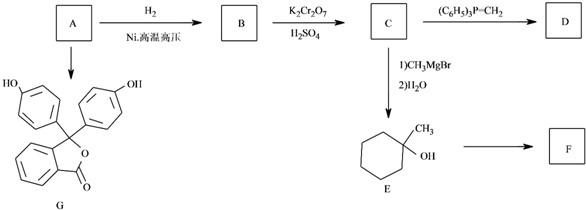
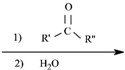
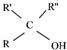
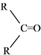 $\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$
$\stackrel{(C_{6}H_{5})_{3}P=CH_{2}}{→}$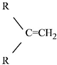 (R表示烃基,R′和R″表示烃基或基)
(R表示烃基,R′和R″表示烃基或基) .
. 、
、 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
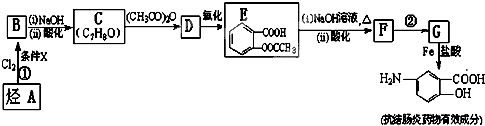
 .
. .
.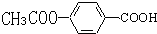
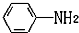 易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物
易被氧化,苯环上连有烷基时再引入一个取代基,常取代在烷基的邻对位,而当苯环上连有羧基时则取代在间位.据此写出以A为原料合成化合物 的合成路线
的合成路线 .(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)
.(仿照题中抗结肠炎药物有效成分的合成路线的表达方式答题)查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com