
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度不计)将容器分成两部分,当左边充入 1mol N2, 右边充入 CO 和 CO2 的混合气体共 8g 时,隔板处于如图位置(保持温度不变),下列说法正确的是

A. 右边 CO 与 CO2 分子数之比为 1:3
B. 右侧 CO 的质量为 2.75g
C. 若改变右边 CO 和 CO2 的充入量而使隔板处于离右端1/6处, 保持温度不变,则前后两次充入容器内的气体压强之比为 5: 3
D. 右侧气体密度是相同条件下氢气密度的 16 倍
【答案】CD
【解析】
左右两侧气体温度、压强相同,相同条件下,体积之比等于物质的量之比,左右体积之比为4:1,则左右气体物质的量之比为4:1,所以右侧气体物质的量=![]() =0.25mol,CO和二氧化碳质量为8g,设CO的物质的量为xmol,则二氧化碳物质的量为(0.25-x)mol,28xg+44(0.25-x)g=8g,x=
=0.25mol,CO和二氧化碳质量为8g,设CO的物质的量为xmol,则二氧化碳物质的量为(0.25-x)mol,28xg+44(0.25-x)g=8g,x=![]() mol,则CO的物质的量为
mol,则CO的物质的量为![]() mol,二氧化碳物质的量为
mol,二氧化碳物质的量为![]() mol。A.气体的物质的量之比等于其分子数之比,所以右边CO与CO2分子数之比为
mol。A.气体的物质的量之比等于其分子数之比,所以右边CO与CO2分子数之比为![]() mol:
mol:![]() mol=3:1,故A错误;B.m(CO)=nM=
mol=3:1,故A错误;B.m(CO)=nM=![]() mol×28g/mol=5.25g,故B错误;C.若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,则左右空间体积之比为5:1,充入CO和CO2物质的量为
mol×28g/mol=5.25g,故B错误;C.若改变右边CO和CO2的充入量而使隔板处于距离右端1/6处,则左右空间体积之比为5:1,充入CO和CO2物质的量为![]() ×1=0.2mol,相同条件下气体的物质的量之比等于其压强之比,所以其压强之比为0.25mol:0.2mol=5:4,故C正确;D.相同条件下气体密度之比等于其摩尔质量之比,右边气体平均摩尔质量=
×1=0.2mol,相同条件下气体的物质的量之比等于其压强之比,所以其压强之比为0.25mol:0.2mol=5:4,故C正确;D.相同条件下气体密度之比等于其摩尔质量之比,右边气体平均摩尔质量=![]() =32g/mol,与氧气摩尔质量相等,所以混合气体与氢气密度之比为32:2=16:1,故D正确;故选CD。
=32g/mol,与氧气摩尔质量相等,所以混合气体与氢气密度之比为32:2=16:1,故D正确;故选CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列有关化学键的说法中正确的是( )
A. 碘晶体升华和冰熔化时都涉及化学键的变化
B. 氯化钠熔化或氯化氢溶于水时都要破坏化学键
C. 离子化合物中可能含有共价键,共价化合物中可能含有离子键
D. 氯化铵受热变成气体,冷却后又成晶体,此过程中化学键没有发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA是阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数为0.1 NA
B. 常温下,78 g Na2O2中含有的阴离子数是2NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. pH=1的H2SO4溶液中,含有H+的数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 电解精炼铜时,粗铜与直流电源的负极相连
B. 镀层破损后,镀锡铁片中铁比镀锌铁片中铁耐腐蚀
C. 常温时,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液pH=7
D. 合成氨反应N2(g) + 3H2(g)![]() 2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
2NH3(g),当2v(N2)正 = v(NH3)逆时,反应达到平衡
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.05 mol Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是( )
加入物质 | 结论 | |
A | 50 mL 1 mol·L-1H2SO4 | 反应结束后,c(Na+)=c(SO |
B | 0.05 mol CaO | 溶液中 |
C | 50 mL H2O | 由水电离出的c(H+)·c(OH-)不变 |
D | 0.1 mol NaHSO4固体 | 反应完全后,溶液pH减小,c(Na+)不变 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离子方程式正确的是( )
A. 醋酸溶解水垢中的CaCO3:CaCO3+2H+===Ca2++H2O+CO2↑
B. 铜与稀硝酸反应:3Cu+8H++2NO3—===3Cu2++2NO↑+4H2O
C. 用热的NaOH溶液溶解S:3S+4OH-![]() 2S2-+SO2↑+2H2O
2S2-+SO2↑+2H2O
D. 向氨水中通入过量SO2:2NH3·H2O+SO2===2NH![]() +SO32—+H2O
+SO32—+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如图所示。C为常见的调味品,D是常见的无色液体。E、F、H和J均为气体,其中H和J为单质,且两者在一定条件下可生成E。
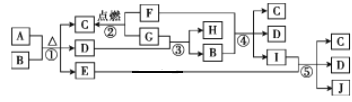
(1)物质的性质决定物质的用途。物质I的溶液可用作家用消毒剂、漂白液,是因为物质I具有__性。
(2)写出反应①的化学方程式:_____。
(3)写出反应③的化学方程式,并用单线桥表示电子转移的方向和数目:___。
(4)写出反应④的离子方程式:____。
(5)写出反应⑤的化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究同主族非金属元素性质的递变规律,某研究性学习小组的甲同学设计了如图所示的实验装置,其中A装置内可生成Cl2。

(1)甲同学的部分实验记录如下:B处棉花变成蓝色;C处棉花变成橙红色。甲同学由此现象得出的结论是同主族从上到下元素的非金属性减弱。
①B处发生反应的化学方程式为______________________________。
②甲同学的结论是________(填“正确”或“不正确”)的,理由是____________________。
(2)乙同学认为应将甲同学实验中B、C两处的棉花调换位置,用氯气先置换出溴,然后溴再与KI接触,以判断Br2与KI能否发生反应。该设想是________(填“合理”或“不合理”)的,原因是_________________________________________。
(3)丙同学在甲同学的实验结束后,取出C处的棉花,将其与另一个沾有淀粉KI溶液的棉花(E)接触,发现E慢慢出现蓝色,结合甲的实验现象,他认为可以确定同主族元素非金属性的递变规律,你同意此种观点吗?______(填“同意”或“不同意”),理由是_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com