
| A、苯的硝化、酯化反应均可看作取代反应 |
| B、乙酸、乙酸乙酯互为同分异构体 |
| C、乙醇和乙酸分子中都含有羟基,它们都能和氢氧化钠反应生成H2O |
| D、糖类、油脂和蛋白质都能发生水解,充分燃烧的产物都是CO2和H2O |
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:
| A、第七周期第ⅤA族 |
| B、第六周期第ⅢB族 |
| C、第七周期第Ⅷ族 |
| D、第六周期第ⅣB族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 化学式 | 相对分子质量 | ||
| 盐酸 | HCl | 36.5 | 密度:1.20g?mL-1 质量分数:36.5%,无色易挥发 |
| 氢氧化钠 | NaOH | 40 | 俗名:烧碱、火碱、苛性钠,易潮解的固体 |


查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NF3分子中所有原子共平面 |
| B、NF3在反应中既做氧化剂又做还原剂 |
| C、生成0.2mol HNO3时转移0.2mol电子 |
| D、氧化产物与还原产物的物质的量之比为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、实验室用大理石跟稀盐酸制取二氧化碳:2H++CO32-=CO2↑+H2O |
| B、将铝粉投入氢氧化钠溶液中:2Al+2OH-=2AlO2-+H2↑ |
| C、向Ca(ClO)2溶液中通过量CO2气体:Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO |
| D、硅酸钠溶液与醋酸溶液混合:SiO32-+2CH3COOH=H2SiO3↓+2CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:
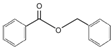 )可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
)可用于治疗疥螨,抗寄生虫,也可作麝香定香剂及樟脑代用品等.合成苯甲酸苄酯的方法有多种,下列路线是其中的两种合成方法:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com