
| A. | 卤化氢中,以HF沸点最高,是由于HF分子间存在氢键 | |
| B. | 邻羟基苯甲醛的熔、沸点比对羟基苯甲醛的熔、沸点低 | |
| C. | H2O的沸点比HF的沸点高,是由于水中氢键键能大 | |
| D. | 氨气极易溶于水与氨气分子和水分子形成氢键有关 |
分析 A、氢键的存在物质的熔沸点异常的高;
B、能形成分子间氢键的物质沸点较高;
C.H2O分子中的O与周围H2O分子中的两个H原子生成两个氢键,而HF分子中的F原子只能形成一个氢键;
D、分子间存在氢键溶解性增强;
解答 解:A.卤化氢中,F元素非金属性最强,HF分子间易形成氢键,使其沸点升高,故A正确;
B、能形成分子间氢键的物质沸点较高,邻羟基苯甲醛容易形成分子内氢键,对羟基苯甲醛易形成分子间氢键,所以邻羟基苯甲醛的沸点比对羟基苯甲醛的沸点低,故B正确;
C.H2O分子中的O与周围H2O分子中的两个H原子生成两个氢键,而HF分子中的F原子只能形成一个氢键,氢键越多,熔沸点越高,所以H2O熔沸点高,与键能的大小无关,故C错误;
D.氨分子与水分子之间能形成氢键,使氨气的溶解度增大,所以氨气极易溶于水,与氢键有关,故D正确.
故选C.
点评 本题考查氢键的形成与性质,题目难度不大,注意氢键与分子间作用力、化学键的区别,易错点为氢键对物质性质的影响.


科目:高中化学 来源:2016-2017学年重庆市高二上第一次月考化学卷(解析版) 题型:选择题
化学与生活、生产密切相关。下列生活、生产中使用的化学品的溶液能够使pH试纸变蓝,且原因是水解引起的是
A.烧碱 B.食用醋 C.氯化铵 D.纯碱
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若管道漏气遇氨就会产生白烟 | B. | 该反应利用了Cl2的强氧化性 | ||
| C. | 生成1 mol N2有3 mol 电子转移 | D. | 该反应不属于复分解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X只能形成一种氧化物 | |
| B. | 化合物YX比WX3的熔点高 | |
| C. | 元素W的最高价氧化物对应水化物的酸性比Z的弱 | |
| D. | 原子半径的大小顺序:r(X)<r(Y)<r(Z)<r(W) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 气态氢化物的稳定性:D>C | B. | 四种元素一定属于短周期元素 | ||
| C. | 单质的还原性:B>A | D. | 原子序数:b>a>c>d |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
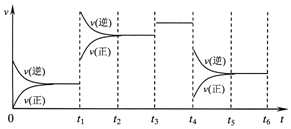 某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )
某密闭容器中发生如下反应:X(g)+3Y(g)?2Z(g);△H<0,如图表示该反应的速率(v)随时间(t)变化的关系,t1、t3、t4时刻外界条件有所改变,但都没有改变各物质的初始加入量.下列说法中不正确的是( )| A. | t1时升高了温度 | B. | t3时加入了催化剂 | ||
| C. | t5~t6时刻,Y转化率最小 | D. | 在t3~t4时间内,X的体积分数最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 |  |  |  |
| 古代与现代的冶金均运用了相同的化学原理 | 古代与现代的火箭发射均利用了液体燃料 | 古代捣碎中药与现代中药纳米粉碎均是化学变化 | 古代风筝与现代热气球飞行均无需物质直接供给能量 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.| 元素代号 | I1 | I2 | I3 | I4 |
| Q | 2 080 | 4 000 | 6 100 | 9 400 |
| R | 500 | 4 600 | 6 900 | 9 500 |
| S | 740 | 1 500 | 7 700 | 10 500 |
| T | 580 | 1 800 | 2 700 | 11 600 |
| U | 420 | 3 100 | 4 400 | 5 900 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com