
【题目】由乙烯推测丙烯的结构或性质,正确的是( )
A.分子中3个碳原子在同一直线上
B.分子中所有原子都在同一平面上
C.分子中共价键的夹角均为120°
D.分子中共价键数为8,其中有一个碳碳双键
【答案】D
【解析】
A.丙烯CH2===CH—CH3结构中可看作是CH2===CH2结构中一个氢原子被一个—CH3所替代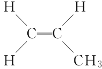 ,显然3个碳原子不在同一条直线上,A错误;
,显然3个碳原子不在同一条直线上,A错误;
B.由于—CH3中4个原子不在同一平面上,所以CH2==CH—CH3分子中所有原子不可能都在同一平面上,B错误;
C.丙烯分子中可以看作一个—CH3取代了CH2==CH2中的一个氢原子,又可以看作一个CH2==CH—取代了甲烷中的一个氢原子,共价键的夹角既有接近120°,又有部分接近109°28′,C错误;
D. 分子中有6个碳氢键、另外3个碳原子两两连接成链状,有2个碳碳键,其中有1个碳碳双键、另有1个碳碳单键,所以共价键数为8,D正确;
答案选D。


科目:高中化学 来源: 题型:
【题目】磺酰氯(SO2C12)是有机合成领域常用的氯化剂、磺化剂、氯磺化剂,熔点-54.1℃,沸点69.1℃,在潮湿空气中会产生酸雾,高温下容易分解。某化学小组用下图所示装置制取磺酰氯,反应原理是:SO2(g)+C12(g)=SO2C12 (1)△H=-97.3kJ/mol,请回答相关问题。

(1)仪器组装好以后首先要进行的操作是____。
(2)装置E的仪器名称是___,所装药品是____。
(3)若缺少装置B,三颈烧瓶中会发生的主要副反应化学方程式是____(任写一个)。装置B更换为某装置后可起到同样的作用,该装置可以是____。
(4)通过气体流量计测得通入Cl2的体积折合成标准状况为3.36L(SO2足量),最终得到的SO2C12质量为8.1g,则产率___。下列措施能提高SO2C12产率的是___。(填选项序号)
a.加快通入氯气的速率
b.三颈烧瓶温度过高时适当冷却
c.先打开分液漏斗活塞并通入氯气再通入冷凝水
(5)某同学在实验过程中不小心将SO2C12与H2SO4混合在一起,分离该混合物的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“绿水青山就是金山银山”,研究氮氧化物等大气污染物对建设美丽家乡,打造宜居环境具有重要意义。NO在空气中存在如下反应:2NO(g)+ O2(g)![]() 2NO2(g)△H上述反应分两步完成,如下左图所示。
2NO2(g)△H上述反应分两步完成,如下左图所示。
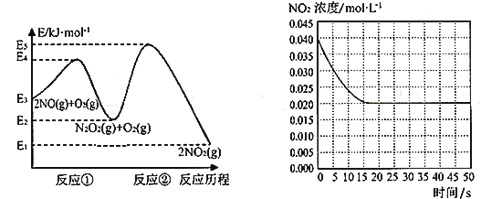
(1)写出反应①的热化学方程式(△H用含物理量E的等式表示):________。
(2)反应①和反应②中,一个是快反应,会快速建立平衡状态,而另一个是慢反应。决定2NO(g)+O2(g)![]() 2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
2NO2(g)反应速率的是____(填“反应①”或“反应②”);对该反应体系升高温度,发现总反应速率变慢,其原因可能是____(反应未使用催化剂)。
(3)某温度下一密闭容器中充入一定量的NO2,测得NO2浓度随时间变化的曲线如上图所示。前5秒内O2的平均生成速率为_______;该温度下反应2NO+O2![]() 2NO2的化学平衡常数K为_____。
2NO2的化学平衡常数K为_____。
(4)对于(3)中的反应体系达平衡后(压强为P1),若升高温度,再次达平衡后,混合气体的平均相对分子质量_____(填“增大”、“减小”或“不变”);若在恒温恒容条件下,向其中充入一定量O2,再次达平衡后,测得压强为P2,c(O2)=0.09mol·L-1,则P1︰P2=___________。
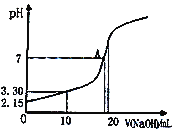
(5)水能部分吸收NO和NO2混合气体得到HNO2溶液。若向20.00mL0.10mol·L-1HNO2溶液中逐滴加入0.10mol·L-1NaOH溶液,所得pH曲线如图所示,则A点对应的溶液c(Na+)/c(HNO2)=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
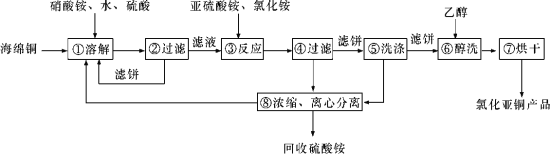
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:_________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是_______(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是__________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:______________。
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是_________;温度过高、pH过大也会影响CuCl产率的原因是____________。
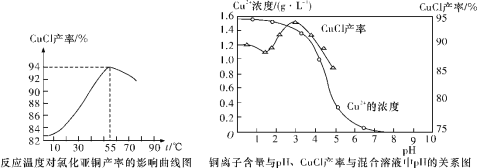
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
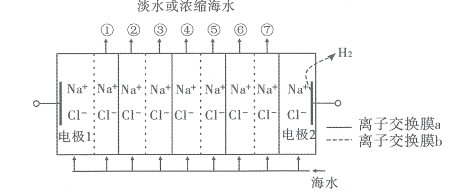
A. 离子交换膜b为阳离子交换膜
B. 各间隔室的排出液中,①③⑤⑦为淡水
C. 通电时,电极l附近溶液的pH比电极2附近溶液的pH变化明显
D. 淡化过程中,得到的浓缩海水没有任何使用价值
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】BaCl2可用于电子、仪表等工业。以毒重石(主要成分为BaCO3,含少量的CaCO3、MgSO4、Fe2O3、SiO2等杂质)为原料,模拟工业制取BaCl2·2H2O的流程如下图所示:

已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9。
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.0 | 3.7 |
(1)盐酸浸取时需要适当加热的原因是_____。
(2)滤渣Ⅰ的成分为_____。
(3)加入H2C2O4时应避免过量,其原因是_____。
(4)用37%的盐酸配制15%的盐酸需用到的仪器有_____(填字母)。
A.量筒 B.烧杯 C.容量瓶 D.玻璃棒
(5)滤渣Ⅲ需经过洗涤后才能进行后续加工处理的原因是_____。
(6)请补充完整由碳酸钡石(含30%CaCO3的BaCO3矿石)模拟工业制取BaCl2·2H2O的实验步骤为_____,过滤,用无水乙醇洗涤2~3次,低温干燥。(实验中可使用的试剂有:冷水,80℃热水,0.1mol·L-1盐酸,6mol·L-1盐酸)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能证明乙烯分子中含有一个碳碳双键的事实是( )。
A.乙烯分子中碳、氢原子个数比为![]()
B.乙烯完全燃烧生成的![]() 和水的物质的量相等
和水的物质的量相等
C.乙烯易与![]() 发生加成反应,且
发生加成反应,且![]() 乙烯完全加成需要消耗
乙烯完全加成需要消耗![]()
D.乙烯能使酸性高锰酸钾溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是

A. AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B. AlF3晶体的晶格能小于NaCl晶体的晶格能
C. 同族元素的氧化物可以形成不同类型的晶体
D. 不同族元素的氯化物可以形成相同类型的晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和硼的化合物在工业上有着广泛的用途。
(1)基态硼原子的电子排布式为___________________________。
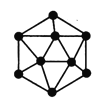
(2)晶体硼的基本结构单元是由硼原子构成的正二十面体(如下图),其中有20个等边三角形的面和一定数目的顶点,每个顶点各有一个硼原子。此结构单元中含有硼原子的数目为________________。
(3)氮化硼(BN)晶体有多种结构。六方氮化硼与石墨相似,具有层状结构,可作高温润滑剂。立方氮化硼是超硬材料,有优异的耐磨性。它们的晶体结构如图所示。关于这两种晶体的说法中,正确的是____(填标号)。

a.立方相氮化硼含有σ键和π键,所以硬度大
b.六方相氮化硼层间作用力小,所以质地软
c.两种晶体中的 B—N 键均为共价键
d.两种晶体均为分子晶体
(4)六方氮化硼晶体内硼原子的杂化方式为________,该晶体不导电的原因是___________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。与BF4—互为等电子体的一种分子的化学式为__, lmolNH4BF4晶体中含有配位键的数目为_____________。
(6)立方氮化硼的结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,则立方氮化硼的一个晶胞中含有______个硼原子,立方氮化硼的密度是____gcm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com