
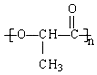
 一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )
一次性使用的聚苯乙烯材料带来的“白色污染”就是一种较为严重的污染现象,最近研制的一种新型材料 能代替聚苯乙烯.它是由乳酸聚合而成的.这种材料可以在乳酸菌作用下完全降解.下列关于聚乳酸的说法正确的是( )| A. | 聚乳酸是一种纯净物 | B. | 聚乳酸的聚合方式与聚苯乙烯相似 | ||
| C. | 聚乳酸的单体为CH3CH(OH)COOH | D. | 聚乳酸的链节为n |
分析 乳酸为CH3-CH(OH)-COOH,含有羟基、羧基,发生缩聚反应生成 ,为聚乳酸,以此解答该题.
,为聚乳酸,以此解答该题.
解答 解:A.从聚乳酸结构可知,聚乳酸是高分子化合物,因高分子化合物中的n值不定,故其为混合物,故A错误;
B.根据聚乳酸的结构可知,该物质是乳酸羟基和羧基脱水的产物,属于缩聚反应,聚苯乙烯是由单体:CH2=CH-C6H5碳碳双键加聚而成,故B错误;
C.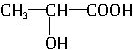 为聚乳酸的单体,故C正确;
为聚乳酸的单体,故C正确;
D. 的聚合度为n,链节为重复出现的结构单元,故D错误.
的聚合度为n,链节为重复出现的结构单元,故D错误.
故选C.
点评 本题考查高聚物的结构和性质,侧重于双基的考查,有利于培养学生良好的科学素养,答题时注意把握有机物的结构特点和官能团的性质,该题注意加聚和缩聚的区别,题目难度不大.


科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
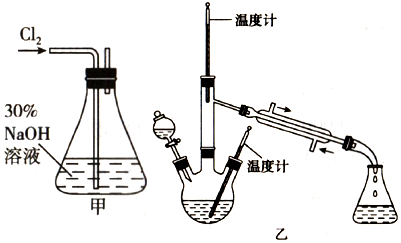 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4•H2O):查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将NaHCO3固体加入新制氯水中,有无色气泡(H+) | |
| B. | 新制氯水呈黄绿色(Cl2) | |
| C. | 使蓝色石蕊试纸先变红后褪色(H+、Cl2) | |
| D. | 滴加AgNO3溶液生成白色沉淀(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 一定状况下,气体摩尔体积(Y)与该气体的物质的量(X)的关系 | |
| B. | 在光照情况下,一定体积的饱和氯水的pH(Y)随时间(X)的关系 | |
| C. | 100℃,1个大气压下,按体积比1:1混合的CO2和H2O(g)混合气通过足量Na2O2粉末,固体增加的质量(Y)与混合气体积(X)的关系 | |
| D. | 向AlCl3溶液中滴加NaOH溶液至过量,生成Al(OH)3 的物质的量(Y)与消耗NaOH的物质的量(X)的关系 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在一定条件下,苯分别与液溴、硝酸、硫酸作用生成溴苯、硝基苯、苯磺酸的反应都属于取代反应 | |
| B. | 己烷有4种同分异构体,它们的熔点、沸点各不相同 | |
| C. | 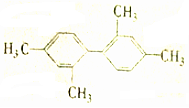 分子中至少有11个碳原子处于同一平面 分子中至少有11个碳原子处于同一平面 | |
| D. | 聚合物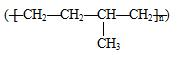 可由单体CH3CH=CH2和CH2=CH2加聚制得 可由单体CH3CH=CH2和CH2=CH2加聚制得 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 增大反应物浓度,可增大单位体积内活化分子的百分数 | |
| B. | 对于有气体参加的化学反应,若增大压强,可增大活化分子的百分数 | |
| C. | 升高温度,可以增大活化分子百分数 | |
| D. | 活化分子间的碰撞一定是有效碰撞 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
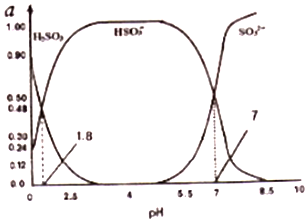
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
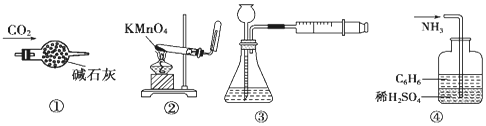
| A. | 装置①:干燥CO2 | B. | 装置②:实验室制取并收集O2 | ||
| C. | 装置③:装置气密性的检查 | D. | 装置④:吸收NH3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com