
| A. | 0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全:c (NH4+)>c (OH-)>c (SO42-)>c (H+) | |
| B. | 向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-) | |
| C. | 0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,所得溶液呈碱性:c (Na+)>c (CN-)>c (HCN)>c (OH-)>c (H+) | |
| D. | 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中:2c(CO32-)+c(HCO3-)=0.1mol/L |
分析 A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全生成BaSO4、NH3•H2O、H2O,NH4HSO4+Ba(OH)2=BaSO4↓+NH3•H2O+H2O,溶液显碱性;
B.向1L 1mol/L 的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液,反应为:4Cl2+8KOH=6KCl+KClO+KClO3+4H2O;
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,得到等浓度的NaCN和HCN,所得溶液呈碱性说明酸电离大于CN-离子的水解;
D.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,溶液中电荷守恒分析判断;
解答 解:A.0.1 mol/L的NH4HSO4溶液中滴加0.1 mol/L的Ba(OH)2溶液至沉淀刚好完全生成BaSO4、NH3•H2O、H2O,NH4HSO4+Ba(OH)2=BaSO4↓+NH3•H2O+H2O,一水合氨电离溶液显碱性,溶液中离子浓度为;c (OH-)>c (NH4+)>c (H+)>c (SO42-),故A错误;
B.电荷守恒:c (K+)+c (H+)=c(Cl-)+c (ClO3- )+c (ClO- )+c (OH- ),得失电子守恒:c(Cl- )=5c (ClO3- )+c (ClO- )+c (HClO),将电子守恒等式代入上式c (K+)+c (H+)=6c (ClO3-)+2c (ClO-)+c (HClO)+c (OH-),故B正确;
C.0.1 mol/L的NaOH溶液与0.2 mol/L的HCN溶液等体积混合,得到等浓度的NaCN和HCN,所得溶液呈碱性说明酸电离大于CN-离子的水解在离子浓度大小为:c (HCN)>c (Na+)>c (CN-)>c (OH-)>c (H+),故C错误;
D.若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,c(OH-)=c(H+),溶液中电荷守恒:2c(CO32-)+c(HCO3-)+c(OH-)=c(Na+)+c(H+),2c(CO32-)+c(HCO3-)=c(Na+)=0.2mol/L,故D错误;
故选B.
点评 本题考查了电解质溶液中物料守恒、电荷守恒分析,反应后溶液中微粒的浓度大小比较,注意氧化还原反应电子守恒的理解应用,掌握基础是解题关键,题目难度中等.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 用洁净的铂丝蘸取溶液在火焰上灼烧,产生黄色火焰,则原溶液中一定不含有K+ | |
| B. | 加入碳酸钠溶液产生白色沉淀,再加入盐酸白色沉淀消失,一定有Ba2+ | |
| C. | 检验Na2CO3固体中是否混有NaHCO3,可向固体滴加稀盐酸,观察是否产生气体 | |
| D. | 向无色溶液中加入稀盐酸无现象,再加入BaCl2有白色沉淀生成,则该溶液中一定含有SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的氢化物的沸点可能高于Y的氢化物的沸点 | |
| B. | 原子半径比较:X<Y<Z<W | |
| C. | X2H4与H2W都能使溴水褪色,且褪色原理相同 | |
| D. | 短周期所有元素中,Z的最高价氧化物的水化物碱性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 熔沸点:YX>W单质>WZ2;离子半径:Z2->Y+>X3+ | |
| B. | YXWZ3中既有离子键又有共价键,其溶液存在多种平衡,溶液呈酸性 | |
| C. | Y与W形成原子数目之比为1:1化合物的电子式表示形式为 | |
| D. | X2WZ4在水中能电离:X2WZ4=2X++WZ42-,所以X2WZ4为离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作及现象 | 结论 |
| A | 用铂丝蘸取某待测液在酒精灯外焰上灼烧,火焰呈紫色(透过蓝色钴玻璃) | 待测试液中可能含钠元素 |
| B | 向某无色溶液中通人过量的CO2气体,有白色沉淀产生 | 该溶液中一定含有SiO32- |
| C | 向品红溶液中通入某气体后,溶液褪色 | 该气体一定是SO2 |
| D | 向NaOH溶液中滴加少量MgCl2溶液,产生白色沉淀,继续滴加FeCl3溶液产生红褐色沉淀 | Fe(OH)3的溶解度小于Mg(OH)2的溶解度 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题.
现有A、B、C、D、E、F六种元素,其中前四种为短周期主族元素,后两种为第四周期元素,它们的原子序数依次增大.A元素原子的核外p电子总数比s电子总数少1;B元素原子核外s电子总数与p电子总数相等,且不与A元素在同一周期;C原子核外所有p轨道全满或半满;D元素的主族序数与周期数的差为4;E是前四周期中电负性最小的元素;F在周期表的第七列.请根据以上相关信息,回答下列问题. 如图,违背了泡利不相容原理.
如图,违背了泡利不相容原理.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )
电解质溶液的电导率越大,导电能力越强.用0.100mol•L-1的NaOH溶液滴定10.00mL浓度均为0.100mol•L-1的盐酸和CH3COOH溶液.利用传感器测得滴定过程中溶液的电导率如图所示.下列说法正确的是( )| A. | 曲线①代表滴定HCl溶液的曲线 | |
| B. | A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1 mol•L-1 | |
| C. | 在相同温度下,A、B、C三点溶液中水的电离程度:C<B<A | |
| D. | D点溶液中:2c(Na+)=3c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
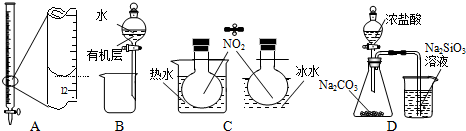
| A. | 装置A记录滴定终点读数为12.20 mL | |
| B. | 装置B可用于提取I2的CCl4溶液中的I2 | |
| C. | 装置C可用于探究温度对2NO2?N2O4平衡体系的影响 | |
| D. | 装置D可用于比较HCl、H2CO3和H2SiO3的酸性强弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com