
| A. | 乙酸是非电解质 | |
| B. | 上述制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH | |
| C. | 上述制备乙酸的反应中原子利用率为80% | |
| D. | 乙酸没有同分异构体 |
分析 A.乙酸在水溶液中存在电离平衡;
B.CO2和CH4直接转化成乙酸,遵循质量守恒定律;
C.反应产物只有一种;
D.乙酸与甲酸甲酯的分子式相同、结构不同.
解答 解:A.乙酸在水溶液中存在电离平衡,则乙酸为弱电解质,故A错误;
B.CO2和CH4直接转化成乙酸,遵循质量守恒定律,制备乙酸的化学方程式为CO2+CH4$\stackrel{Cu_{2}Al_{2}O_{2}}{→}$CH3COOH,故B正确;
C.反应产物只有一种,制备乙酸的反应中原子利用率为100%,故C错误;
D.乙酸与甲酸甲酯的分子式相同、结构不同,则二者互为同分异构体,乙酸有同分异构体,故D错误;
故选B.
点评 本题考查有机物制备的实验评价,为高频考点,把握制备原理、反应特点、同分异构体、电解质等为解答的关键,侧重分析与应用能力的考查,综合性较强,注意实验的评价性分析,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 乙烯和苯使溴水褪色的原因不同 | |
| B. | 苯和氢气在一定条件下生成环己烷的反应为还原反应 | |
| C. | 硝基苯和乙酸乙酯的制备都发生了取代反应 | |
| D. | 由乙醇制取乙烯发生了氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol/L氢氧化钠溶液 | B. | 0.1mol/L氢氧化钡溶液 | ||
| C. | 0.1mol/L氢氧化钾溶液 | D. | 0.1mol/L氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 同分异构体的结构简式.
同分异构体的结构简式.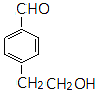 、
、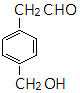 .
.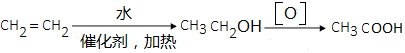 .(无机试剂可以任选)
.(无机试剂可以任选)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | A(KMnO4溶液浓度/mol•L-1) | B(草酸溶液浓度/mol•L-1) | C(硫酸溶液浓度/mol•L-1) | 褪色时间/s |
| 1 | 3 | 3 | 1 | 336 |
| 2 | 1 | 2 | 3 | 82 |
| 3 | 3 | 1 | 3 | 76 |
| 4 | 1 | 3 | 2 | 133 |
| 5 | 2 | 3 | 3 | 102 |
| 6 | 3 | 2 | 2 | 156 |
| 7 | 2 | 2 | 1 | 300 |
| 8 | 2 | 1 | 2 | 115 |
| 9 | 1 | 1 | 1 | 200 |
| A(KMnO4溶液) | B(草酸溶液) | C(硫酸溶液) | |||||||
| 浓度/mol•L-1 | 0.005 | 0.010 | 0.015 | 0.1 | 0.5 | 0.9 | 6 | 12 | 18 |
| 平均褪色时间/s | 138.3 | 172.3 | 189.3 | 130.3 | 179.3 | 190.3 | 278.7 | 134.7 | 86.7 |
| c(H2SO4)/mol•L-1 | 18 | 16 | 14 | 12 | 10 | 8 | 6 |
| 褪色时间/s | 67 | 83 | 90 | 103 | 129 | 146 | 200 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 副族元素中没有非金属 | |
| B. | 除短周期外,其他周期均有18种元素 | |
| C. | ⅠA族的所有元素都为金属元素 | |
| D. | 同周期ⅡA族与ⅢA族元素原子序数相差只有1、11 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 测定等浓度的Na2CO2和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 向氯水中滴加少量品红溶液 | 品红溶液褪色 | Cl2有漂白性 |
| C | 向等浓度的KCI、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Kap(AgCl)<Kap(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静置 | 下层液体呈紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com