
反应X(g)+Y(g) 2Z(g);
2Z(g);
 H<0,达到平衡时,下列说法正确的是
H<0,达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
科目:高中化学 来源: 题型:
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根
据I2析出所需时间可以求得NaHSO3的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0ml、
KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结
果如右图。据图分析,下列判断不正确的是
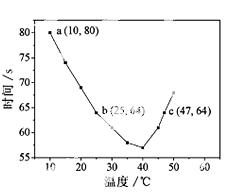
A.40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反
B.图中b、c两点对应的NaHSO3反应速率相等
C.图中a点对应的NaHSO3反应速率为5.0 ×10-5mol·L-1·s-1
D.温度高于40℃时,淀粉不宜用作该试验的指示剂
查看答案和解析>>
科目:高中化学 来源: 题型:
下述实验不能达到预期实验目的的是
| 选项 | 实验内容 | 实验目的 |
| A | 将2.5 g CuSO4·5H2O溶解在97.5 g 水中 | 配制质量分数为1.6%的CuSO4溶液 |
| B | 向盛有1 mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 | 说明一种沉淀能转化为另一种溶解度更小的沉淀 |
| C | 取少量待检固体溶于水中,滴加少量Ba(OH)2溶液,观察是否有白色沉淀生成 | 检验NaHCO3固体中是否含Na2CO3 |
| D | 取出分液漏斗中所需的上层液体 | 下层液体从分液漏斗下端管口放出,关闭活塞,换一个接收容器,上层液体从分液漏斗上口倒出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
生活和生产中常用到胶体的性质,请看下述三例:
(1)医学上治疗由肾功能衰竭等疾病引起的血液中毒时,最常用的血液 净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的________类似,透析膜同________类似,透析膜的孔径应________(填“大于”“小于”或“等于”)血液内毒性物质粒子的直径,毒性物质才可能扩散到透析液中而被除去。
净化手段是血液透析。透析时,病人的血液通过浸在透析液中的透析膜进行循环和透析。透析原理同胶体的________类似,透析膜同________类似,透析膜的孔径应________(填“大于”“小于”或“等于”)血液内毒性物质粒子的直径,毒性物质才可能扩散到透析液中而被除去。
(2)在陶瓷工业上常遇到因陶土里混有氧化铁而影响产品质量的情况。解决方法之一是把这些陶土和水一起搅拌,使微粒直径在10-9~10-7m之间,然后插入两根电极,再接通直流电源。这时,阳极聚集_______,阴极聚集________,理由是______________________________。
(3)水泥和冶金工厂常用高压电对气溶胶作用除去大量烟尘,以减少对空气的污染,这种 做法运用了________原理。
做法运用了________原理。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下,可逆反应X(g) + 3Y(g)  2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
2Z(g),若X、Y、Z起始浓度分别为c1、c2、c3(均不为0,单位mol/L),当达平衡时X、Y、Z的浓度分别为0.1mol/L,0.3mol/L,0.08mol/L,则下列判断不合理的是
 A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
A.c1:c2 = 1:3 B.平衡时,Y和Z的生成速率之比为3:2
C.X、Y的转化率不相等 D.c1的取值范围为0 < c1 < 0.14mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
某市对大气进行监测,发现该市首要污染物为可吸入颗粒物PM2.5(直径小于等于2.5μm的悬浮颗粒物)其主要来源为燃煤、机动车尾气等。因此,对PM2.5、SO2、NOx等进行研究具有重要意义。请回答下列问题:
(1)对PM2.5样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表:
| 离子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
| 浓度/mol.L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根据表中数据判断PM2.5的酸碱性为 ,试样的pH值 。
(2)为减少SO2的排放,常采取的措施有:
①将煤转化为清洁气体燃料。已知:H2(g)+1/2O2(g)=H2O(g)  H= -241.8KJ/mol
H= -241.8KJ/mol
C(s)+1/2O2(g)=CO(g)  H= -110.5KJ/mol
H= -110.5KJ/mol
写出焦炭与水蒸气反应的热化学方程式 ;
②洗涤含SO2的烟气,以下物质可作洗涤剂的是 ;
a.Ca(OH)2 b.Na2CO3 c.CaCl2 d.NaHSO3
(3)汽车尾气中NOx和CO的生成及转化为:
①已知气缸中生成NO的反应为:N2(g)+O2(g)  2NO(g)
2NO(g)  H>0
H>0
若1mol空 气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
气含有0.8molN2和0.2molO2,1300℃时在密闭容器内反应达到平衡。测得NO为8×10-4mol.计算该温度下的平衡常数K= ___________;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是  。
。
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的 H>
H> 0,简述该设想能否实现的依据 。
0,简述该设想能否实现的依据 。
③目前,在汽车尾气系统中装置催化转化器可减少CO和NO的污染,其化学反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法可以证明H2(g)+I2(g)2HI(g)已达平衡状态的是____________(填序号)。
①单位时间内生成n mol H2的同时,生成n mol HI
②一个H—H 键断裂的同时有两个H—I键断裂
③百分含量w(HI)=w(I2)
④反应速率v(H2)=v(I2)=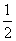 v(HI)
v(HI)
⑤c(HI)∶c(H2)∶c(I2)=2∶1∶1
⑥温度和体积一定时,某一生成物浓度不再变化
⑦温度和体积一定时,容器内压强不再变化
⑧条件一定,混合气体的平均相对分子质量不再变化
⑨温度和体积一定时,混合气体颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应aA(g) + bB(g)  cC(g) + dD(g),反应过程中
cC(g) + dD(g),反应过程中 ,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如图下列叙述正确的是
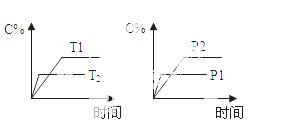 A.达平衡后,若升温,平衡左移
A.达平衡后,若升温,平衡左移
B.达平衡后,加入催化 剂则C%增大
剂则C%增大
C.化学方程式中a+b>c+d
D.达平衡后,减少A的量有利于平衡向右移动
查看答案和解析>>
科目:高中化学 来源: 题型:
0.102 6 mol·L-1的盐酸滴定25.00 mL未知浓度的氢氧化钠溶液,滴定达终点时,滴定管中的液面如图所示,正确的读数为 ( )
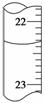 A.22.30 mL B.22.35 mL
A.22.30 mL B.22.35 mL
C.23.65 mL D.23.70 mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com