
| A. | H2SO4是酸,因为H2SO4中含有氢元素 | |
| B. | 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间 | |
| C. | Na和H2O的反应不是离子反应,因为反应中没有离子参加 | |
| D. | Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧 |
分析 A.根据电离时生成的阳离子都是氢离子的化合物是酸;
B.根据胶体分散质粒子直径在1nm~100nm之间;
C.有离子参加或生成的反应是离子反应;
D.Na在Cl2中燃烧是氧化还原反应,因为化合价发生了变化.
解答 解:A.H2SO4是酸,因为H2SO4电离时生成的阳离子都是氢离子,故A错误;
B.豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间,故B正确;
C.Na和H2O的反应是离子反应,因为反应中离子生成,故C错误;
D.Na在Cl2中燃烧是氧化还原反应,因为化合价发生了变化,电子出现了转移,故D错误;
故选B.
点评 本题主要考查了物质的分类,难度不大,掌握分类的依据是解题的关键.


科目:高中化学 来源: 题型:选择题
| A. | 3:1 | B. | 1:3 | C. | 3:2 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应体系的总压恒定 | B. | A、B、C、D的物质的量之比为1:3:2:2 | ||
| C. | c(A):c(B)=1:3 | D. | 2V(B)正=3V(C)逆 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| X | Y | |
| Z | W |
 ,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).
,Y的气态氢化物的稳定性比Z的气态氢化物的稳定性强(填“强”、或“弱”).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+ Na+ OH- SO42- | B. | Mg2+ SO42- NH4+ Cl- | ||
| C. | K+ Na+ HCO3- Cl- | D. | K+ Na+ NO3- CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 实验现象 | 现象解释(用离子方程式表示) | |
| 探究① | A.用玻璃棒蘸取Na2S2O3溶液点在pH试纸中部,将试纸颜色与标准比色卡对照 | a.溶液pH=8 | i.S2O32-+H2O?HS2O3-+OH- |
| B.向pH=2的硫酸中滴加Na2S2O3溶液 | b.有淡黄色沉淀(或乳白色浑浊)和无色刺激性气味气体产生 | ii.S2O32一+2H+=S↓+SO2↑ +H2O | |
| 探究② | C.向新制氯水(pH<2)中滴加少量Na2S2O3溶液 | c.氯水颜色变浅 | iii.S2O32-+4Cl2+5H2O=2SO42-+8Cl-+10H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | (1)(3)(4) | B. | (1)(3)(5) | C. | (2)(4)(5) | D. | (1)(4)(5) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题:
铁(26Fe)是地球上分布最广的金属之一,约占地壳质量的5.1%,居元素分布序列中的第四位,仅次于O、Si和Al.请结合所学知识回答下列问题: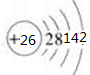
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对处于平衡状态的2HI(g)?H2(g)+I2(g)反应,缩小体积后混合物颜色变深 | |
| B. | 在恒温时,一固定容积的容器内发生如下反应:2NO2(g)?N2O4(g)达平衡时,再向容器内通入一定量的NO2(g),重新达到平衡后,与第一次平衡时相比,NO2的体积分数减小 | |
| C. | 对于可逆反应FeCl3(aq)+3KSCN(aq)?Fe(SCN)3(aq)+3KCl(aq)达到平衡后,向反应体系中加入KCl固体,平衡向逆反应方向移动 | |
| D. | 合成氨时适当增大压强有利于提高氢气的转化率 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com