
【题目】进入冬季北方开始供暖后,雾霾天气愈发严重,各地PM2.5、PM10经常“爆表”。引发雾霾天气的污染物中,最为常见的是机动车尾气中的氮氧化物和燃煤产生的烟气。
I、用NH3催化还原NOx可以消除氮氧化物的污染。反应原理为:NO(g)+NO2(g)+2NH3(g) ![]() 2N2(g)+3H2O(g)。
2N2(g)+3H2O(g)。
(1)该反应的△S________0(填“>”、“=”或“<”)。
(2)II、已知反应N2O4(g) ![]() 2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
2NO2(g) △H,随温度升高,混合气体的颜色变深。将一定量N2O4气体充入绝热容器一段时间后,研究压缩和拉伸活塞过程中混合气体的气体的透光率(气体颜色越浅,透光率越大)随时间变化情况。下列说法能说明透光率不再发生改变的有________。
a.气体颜色不再改变b.△H不再改变
c.v正(N2O4)=2v逆(NO2)d.N2O4的转化率不再改变
(3)III、用CH4催化还原NOx也可以消除氮氧化物的污染。
已知:CH4(g)的标准燃烧热为-890kJ/mol,蒸发1mol H2O(l)需要吸收44kJ热量。
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H=﹣1114 kJ/mol
2NO(g)+O2(g)=2NO2(g)△H=﹣114 kJ/mol
写出CH4催化还原NO2(g)生成N2和H2O(g)的热化学方程式:________。
(4)在温度为T1℃和T2℃时,分别将0.5mol CH4和1.2mol NO2充入体积为1L的密闭容器中,测得NO2的物质的量随时间变化数据如下表:
温度/℃ | 0 | 10 | 20 | 40 | 50 |
T1 | 1.2 | 0.9 | 0.7 | 0.4 | 0.4 |
T2 | 1.2 | 0.8 | 0.56 | … | 0.5 |
①温度为T1℃时,0~20min内,v(CH4)=________。
②温度为T2℃时,达平衡后,再向容器中加入0.5mol CH4和1.2mol NO2,达新平衡时CH4的转化率将________(填“增大”、“减小”或“不变”)。
【答案】> ad CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H=-844kJ/mol 0.0125mol/(Lmin) 减小
【解析】
(1)由于反应前后气体分子数增大,因此ΔS>0;
(2)a、气体颜色不再改变时,反应达到平衡状态,透光率不再改变,a符合题意;b、ΔH是表示反应的热效应,只与物质具有能量的相对大小有关,ΔH不变,不能说明反应达到平衡状态,b不符合题意;c、根据反应速率之比等于化学计量系数之比可得,当反应达到平衡状态时,2v正(N2O4)=v逆(NO2),c不符合题意;d、当N2O4的转化率不再改变时,说明反应达到平衡状态,此时透光率不再改变,d符合题意;故答案为ad;
(3)CH4(g)燃烧热的热化学方程式为: ![]() ①,
①,
H2O(l)转化为H2O(g)的热化学方程式为:![]() ②;又已知:
②;又已知:![]() ③,
③,
![]() ④,
④,
①+2×②+③-2×④,得到反应:![]() ,相应的
,相应的![]() ,把方程式的系数和H都除以2,得到CH4催化还原NO2反应的热化学方程式为:
,把方程式的系数和H都除以2,得到CH4催化还原NO2反应的热化学方程式为:![]() 。故答案为:
。故答案为:![]() 。
。
(4)①由表格数据可知,0~20min内,参与反应的n(NO2)=0.5mol,根据反应的化学方程式可知,参与反应的n(CH4)=0.25mol,则0~20min内,用CH4表示的反应速率 ;故答案为:0.0125mol/(Lmin)。
;故答案为:0.0125mol/(Lmin)。
②达到平衡后,再充入0.5molCH4和1.2molNO2,由于温度和容器的体积均不变,因此反应体系的压强增大,平衡逆向移动,因此CH4的转化率减小,故答案为:减小。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】根据下列图示所得出的结论不正确的是
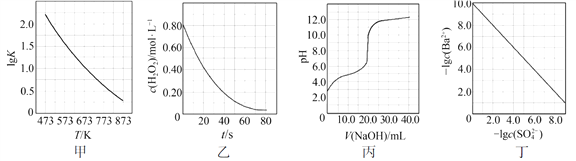
A. 图甲是CO(g)+H2O(g)![]() CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
B. 图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐减小
C. 图丙是室温下用0.1000 mol·L1NaOH溶液滴定20.00 mL 0.1000 mol·L1某一元酸HX的滴定曲线,说明HX是一元强酸
D. 图丁是室温下用Na2SO4除去溶液中Ba2+达到沉淀溶解平衡时,溶液中c(Ba2+ )与c(SO42)的关系曲线,说明溶液中c(SO42 )越大c(Ba2+ )越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如下:

则下列说法正确的是( )
A.试剂a是铁、试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
C.试剂c是氯气,相应的反应为2Fe2++Cl2═2Fe3++2Cl-
D.用酸性KMnO4溶液可检验溶液W中是否含有Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100 mL 0.01 mol·L-1HA溶液中逐滴加入0.02 mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(溶液体积变化忽略不计)。下列说法中,不正确的是( )
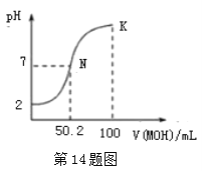
A.HA的电离方程式为:HA=H++A- B.MOH为一元弱碱
C.K点对应的溶液中有:c(MOH)+c(M+)=0.02mol ![]() L-1 D.N点对应的溶液中有:c(M+)=c(A-)
L-1 D.N点对应的溶液中有:c(M+)=c(A-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.含氨废水和废气对环境造成的污染越来越严重,某课外活动小组先测定废水中含NO3-为3×10-4 mol/L,而后用金属铝将NO3-还原为N2,从而消除污染。
(1)配平下列有关离子方程式:_____NO3-+_______Al+_______H2O→_______N2↑+______Al(OH)3+________OH-。
(2)上述反应中被还原的元素是____________,每生成2 molN2转移_________mol电子。
(3)有上述废水100 m3,若要完全消除污染,则所消耗金属铝的质量为_________g。
Ⅱ.NO与Cl2在常温常压下可以合成亚硝酰氯(NOCl)。它是一种红褐色液体或黄色气体,其熔点-64.5 ℃,沸点-5.5℃,遇水易水解。亚硝酰氯(NOCl)是有机合成中的重要试剂。实验室制备原料气Cl2的装置如图所示:
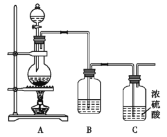
(4)实验室制Cl2时,装置A中烧瓶内发生反应的化学方程式为_________________________。
(5)将上述收集到的Cl2充入D的集气瓶中,按图示装置制备亚硝酰氯。

①装置D中发生的反应方程式为__________________________。
②如果不用装置E会引起什么后果:__________________。
③某同学认为装置F不能有效吸收尾气中的某种气体,该气体为_____________,为了充分吸收尾气,可将尾气与________________同时通入氢氧化钠溶液中。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过渡态理论认为:化学反应并不是通过简单的碰撞就能完成的,而是从反应物到生成物的过程中经过一个高能量的过渡态。如图1为1molNO2与1molCO恰好反应生成CO2和NO过程中的能量变化示意图

(1)试写出NO2和CO反应的热化学方程式:________
(2)在密闭容器中进行的上述反应是可逆反应,图2是某学生模仿图1画出的NO+CO2 =NO2+CO的能量变化示意图。则图中E3=________kJmol-1
(3)在密闭容器中充入1molH2和1molI2 , 压强为p(Pa),并在一定温度下使其发生反应:H2(g)+I2(g)2HI(g)△H<0.保持容器内气体压强不变,向其中加入1molN2 , 反应速率________(填“变大”、“变小”或“不变”),平衡________移动(填“向正反应方向”、“向逆反应方向”或“不”)。
(4)T℃,向1L密闭容器中加入1molHI(g),发生反应2HIH2+I2, H2物质的量随时间的变化如图3所示。
①该温度下,2HI(g)H2(g)+I2(g)的平衡常数K=________
②相同温度下,若开始加入HI(g)的物质的量是原来的2倍,则________是原来的2倍。
a.平衡常数 b.HI的平衡浓度
c.达到平衡的时间 d.平衡时H2的体积分数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25mL 0.1mol·L-1NaOH溶液中逐滴加入0.2mol·L-1CH3COOH溶液,溶液pH变化曲线如图所示,下列有关离子浓度的比较正确的是

A.在A、B间任一点(不含A、B点),溶液中可能有c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
B.在B点,a>12.5,且有c(Na+)=c(CH3COO-)=c(OH-)=c(H+)
C.在C点,c(CH3COO-)>c(Na+)>c(OH-)>c(H+)
D.在D点,c(CH3COO-)+c(CH3COOH)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素原子的核电荷数依次增大![]() 均小于
均小于![]() ,其单质及相应的化合物能发生如下反应关系:
,其单质及相应的化合物能发生如下反应关系:

(1)写出F的电子式 ______ 。
(2)气体H有毒,可用![]() 溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
溶液吸收,生成两种酸式盐,该反应的化学方程式为: ______ 。
(3)加热E的水溶液后并灼烧,最终得到的固体为 ______ ,原因为 ______ 、 ______ ![]() 用化学反应方程式来表示
用化学反应方程式来表示![]() 。
。
(4)室温下,向F的水溶液中加入等体积等浓度的盐酸反应后所得溶液的![]() ,则此溶液中离子浓度由小到大的顺序为: ______ 。
,则此溶液中离子浓度由小到大的顺序为: ______ 。
(5)将气体H放在空气中充分燃烧可得到气体氧化物![]() ,
,![]() 可与氧气继续反应:
可与氧气继续反应:![]() ,在一个固定容积为2L的密闭容器中充入
,在一个固定容积为2L的密闭容器中充入![]() 的
的![]() 和
和![]() 的
的![]() ,半分钟后达到平衡,测得容器中含
,半分钟后达到平衡,测得容器中含![]() 为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入
为0.18mol,则υ(O2)=______ mol/(L·min),若继续通入![]()
![]() 和
和![]()
![]() ,再次达到新平衡后,
,再次达到新平衡后,![]() 的物质的量介于 ______ 之间。
的物质的量介于 ______ 之间。
(6)写出E和F反应的化学反应方程式: ______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向100mL 1molL﹣1H2SO3溶液中逐渐滴入1molL﹣1的NaOH溶液,含硫物质的分布分数δ(平衡时某物质的浓度与各物质浓度之和的比)与pH的关系如图所示(已知:pKs=﹣lgK,25℃时,H2SO3的pKa1=1.85,pKa2=7.19).下列说法不正确的是( )

A.pH=1.85时,c(H2SO3)=c(HSO3﹣)
B.pH=6时,c(Na+)>c(HSO3﹣)>c(SO32﹣)
C.pH=7.19时,c(Na+)+c(H+)=c(HSO3﹣)+2c(SO3﹣)+c(OH﹣)
D.加入150mLNaOH溶液时,3c(Na+)=2c(H2SO3)+2c(HSO3﹣)+2c(SO32﹣)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com