
【题目】(1)在质量分数为28%的KOH水溶液中,OH-与H2O数目之比是________。
(2)由硫酸钾、硫酸铁和硫酸组成的混合溶液,其中c(H+)=0.1 mol/L,c(Fe3+)=0.3 mol/L,c(SO42-)=0.6 mol/L,则c(K+)为________。
(3)相同物质的量浓度的氯化钠、氯化镁、氯化铝溶液,分别与硝酸银溶液反应,当生成沉淀的质量之比为3∶2∶1时,消耗三种盐溶液的体积比为________。
(4)某状况下a L氨气(此时气体摩尔体积为Vm)溶解在一定量的水中形成b mL氨水溶液,所得溶液的密度为ρ g/mL,则该氨水的物质的量浓度可表示为________ mol/L;氨水的质量分数为________。
(5)已知1.505×1023个X气体分子的质量是8 g,则X气体的摩尔质量是________。
【答案】1∶8 0.2 mol/L 9∶3∶1 ![]()
![]() ×100% 32g/mol
×100% 32g/mol
【解析】
(1)假设溶液质量为100g,计算KOH、水的质量,再根据n=![]() 计算KOH、水的物质的量,进而计算OH-与H2O数目之比;
计算KOH、水的物质的量,进而计算OH-与H2O数目之比;
(2)根据电荷守恒计算溶液中c(K+);
(3)均发生Ag++Cl-=AgCl↓,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒计算NaCl、MgCl2、AlCl3的物质的量,再根据V=![]() 可知,溶液浓度相等,体积之比等于物质的量之比;
可知,溶液浓度相等,体积之比等于物质的量之比;
(4)根据n=![]() 计算氨气的物质的量,再根据c=
计算氨气的物质的量,再根据c=![]() 计算溶液物质的量浓度;根据m=n·M计算氨气的质量,根据m=ρ·V计算溶液的质量,氨水的质量分数=
计算溶液物质的量浓度;根据m=n·M计算氨气的质量,根据m=ρ·V计算溶液的质量,氨水的质量分数= ×100%。
×100%。
(5)根据n=![]() 计算气体的物质的量,再根据n=
计算气体的物质的量,再根据n=![]() 计算X气体的摩尔质量。
计算X气体的摩尔质量。
(1)假设溶液质量为100g,则KOH的质量m(KOH)=100g×28%=28g,水的质量m(H2O)=100g-28g=72g,故KOH的物质的量n(KOH)= 28g÷56g/mol=0.5mol、水的物质的量n(H2O)= ![]() =4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8;
=4mol,故溶液中OH-与H2O数目之比=0.5mol:4mol=1:8;
(2)根据电荷守恒可知:c(K+)+ c(H+)+3c(Fe3+)=2c(SO42-),则:c(K+)+0.1mol/L+3×0.3mol/L=2×0.6mol/L,解得c(K+)=0.2mol/L;
(3)相同浓度的NaCl、MgCl2、AlCl3三种溶液分别与硝酸银溶液反应,当生成沉淀的质量之比为3:2:1,设NaCl、MgCl2、AlCl3与硝酸银溶液反应生成AgCl的物质的量分别为3mol、2mol、1mol,根据氯离子守恒,则n(NaCl)=3mol、n(MgCl2)= ![]() =1mol,n(AlCl3)=
=1mol,n(AlCl3)=![]() mol,再根据V==
mol,再根据V==![]() 可知,溶液浓度相等,体积之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:
可知,溶液浓度相等,体积之比等于物质的量之比,故V(NaCl):V(MgCl2):V(AlCl3)=3mol:1mol:![]() mol=9:3:1;
mol=9:3:1;
(4)某状况下气体摩尔体积为VmL/mol,则该状况下aL氨气的物质的量n=![]() mol,溶解在一定量的水中形成b ml氨水溶液,则该氨水的物质的量浓度c=
mol,溶解在一定量的水中形成b ml氨水溶液,则该氨水的物质的量浓度c=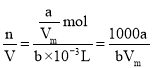 mol/L;所得溶液的密度为ρg/mL,则溶液质量m(溶液)=bρg,氨气的质量m(NH3)=n·M=
mol/L;所得溶液的密度为ρg/mL,则溶液质量m(溶液)=bρg,氨气的质量m(NH3)=n·M=![]() mol×17g/mol=
mol×17g/mol=![]() g,所以氨水的质量分数
g,所以氨水的质量分数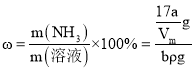 ×100%=
×100%=![]() ×100%;
×100%;
(5) 1.505×1023个X气体分子的物质的量m=![]() =0.25mol,其质量是8 g,则由n=
=0.25mol,其质量是8 g,则由n=![]() 可知X气体的摩尔质量M=
可知X气体的摩尔质量M=![]() =32g/mol。
=32g/mol。


科目:高中化学 来源: 题型:
【题目】氯酸锶[Sr(ClO3)2]用于制造红色烟火。将氯气通入温热的氢氧化锶溶液制得氯酸锶的实验装置如下。已知氢氧化锶[Sr(OH)2]易与盐酸反应,水中存在Cl﹣时,不影响HCl的溶解,但会抑制Cl2的溶解。回答下列问题

(1)Sr(ClO3)2中Cl元素的化合价是_____,装置A中浓盐酸在反应中的作用是_____
(2)Y是_____(填字母),其作用原理是_____
A.浓H2SO4 B.饱和NaCl溶液 C.NaOH溶液
(3)装置D中NaOH溶液的作用是_____
(4)装置C中三颈烧瓶内发生的反应为6Sr(OH)2+6Cl2=Sr(ClO3)2+6H2O+5SrCl2,转移5mol电子时生成Sr(ClO3)2的质量是_____
查看答案和解析>>
科目:高中化学 来源: 题型:
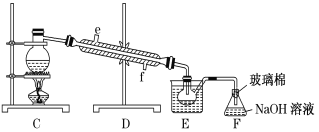
【题目】如图为工业从海水中提取液溴的流程图:
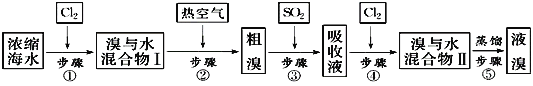
已知:溴的沸点为59℃,微溶于水,有毒性。请回答:
(1)某同学利用下图装置进行步骤①至步骤④的实验,当进行步骤①时,应关闭活塞___,打开活塞____。
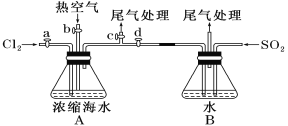
(2)步骤②中可根据___现象,简单判断热空气的流速。
(3)步骤③中简单判断反应完全的依据是___。
(4)从“溴水混合物Ⅰ”到“溴水混合物Ⅱ”的目的是___。
(5)步骤⑤用下图装置进行蒸馏,蒸馏烧瓶中尚未安装温度计,安装其位置时应注意___,装置C中直接加热不合理,应改为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CO2、CO、H2组成的混合气体在同温同压下与氮气的密度相同,则该混合气体中CO2、H2、CO的体积比可为( )
A. 13∶8∶29B. 22∶1∶14
C. 29∶8∶13D. 13∶16∶57
查看答案和解析>>
科目:高中化学 来源: 题型:
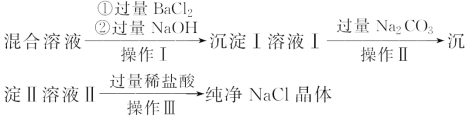
【题目】现有含NaCl、MgCl2和Na2SO4的混合溶液,某兴趣小组的同学欲提取纯净的NaCl晶体,设计了如下实验:
请回答下列问题:
(1)写出沉淀Ⅰ和沉淀Ⅱ所含物质的化学式。沉淀Ⅰ:_________、沉淀Ⅱ:_______。
(2)上述流程中,加入过量稀盐酸的目的是______________。
(3)操作Ⅲ中需使用的玻璃仪器是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有X、Y、Z、M、R五种短周期主族元素,部分信息如下表所示:
X | Y | Z | M | R | |
原子半径/nm | 0.074 | 0.099 | |||
主要化合价 | +4,-4 | -2 | -1,+7 | ||
其它 | 阳离子核外无电子 | 无机非金属材料的主角 | 第三周期简单离子半径最小 |
请回答下列问题:
(1)Z与NaOH溶液反应的离子方程式:___。(用元素符号表示,下同。)
(2)下列事实能说明R非金属性比Y强这一结论的是___(选填字母序号)。
a.常温下Y的单质呈固态,R的单质呈气态
b.气态氢化物稳定性R>Y
c.Y与R形成的化合物中Y呈正价
d.Y与R各自形成的含氧酸中R的氧化性更强
(3)经测定X2M2为二元弱酸,写出X2M2的电子式___。其酸性比碳酸的还要弱,请写出其第一步电离的电离方程式___。
(4)已知I2能做X2M2分解的催化剂:
第一步:X2M2+I2=2XIM;
第二步:……
请写出第二步反应的化学方程式___。
(5)废印刷电路板上含有铜,以往的回收方法是将其灼烧使铜转化为氧化铜,再用硫酸溶解。现在改用X2M2和稀硫酸浸泡废印刷电路板既达到上述目的,又保护了环境,试写出反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式如如图。
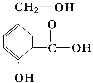
(1)请写出该物质的含氧官能团名称______、______和______。
(2)请写出以下化学反应的方程式:
①A跟NaOH溶液反应:__________
②A跟NaHCO3溶液反应:__________
③A在一定条件下跟Na反应:__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验,将液体A逐滴加入到固体B中,下列叙述正确的是( )
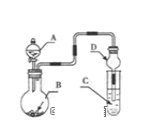
A.若A为浓盐酸,B为Na2SO3,C中盛有Na2SiO3溶液,C中溶液出现白色沉淀,证明酸性:H2SO3> H2SiO3
B.若A为浓盐酸,B为MnO2,C中盛有KI淀粉溶液,C中溶液变蓝色
C.若A为浓氨水,B为生石灰,C中盛有AlCl 3溶液,C中先产生白色沉淀后沉淀溶解
D.若A为H2O2,B为MnO2,C中盛有Na2S溶液,C中溶液变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.下列说法不正确的是_____________(填字母代码)。
A.对于Al(OH)3(s) |
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的 |
C.能源、信息与材料通常被称为现代社会发展的三大支柱 |
D.镀层破损后,白铁(镀锌的铁)比马口铁(镀锡的铁)更易被腐蚀 |
E.除去硬水中的Mg2+,用OH-沉淀Mg2+比用CO32-效果好,说明Mg(OH)2溶解度比 MgCO3的小
II.向含有AgI的饱和溶液中:
(1)加入固体AgNO3,则c(I-)________(填“变大”、“变小”或“不变”,下同)。
(2)若改加更多的AgI,则c(Ag+)___________。
(3)若改加AgCl固体,则c(I-)___________,而c(Ag+)___________。
III.用“>”、“<”或“=”填空:
(1)25℃时1mol/L FeCl3溶液的pH______80℃时1mol/L FeCl3溶液的pH。
(2)已知NaHSO3溶液中c(HSO3-)>c(SO32-)>c(H2SO3),则溶液中c(H+)______c(OH-)。
(3)常温下,取等物质的量浓度的HA溶液与NaOH溶液等体积混合,测得混合溶液的pH=8,混合溶液中由水电离出的c(H+)水______NaOH溶液中由水电离出的c(H+)水。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com