
【题目】按要求填空:
I.(1)AlCl3的水溶液pH______7(填>、=、<=,其原因为______________(用离子方程式表示),将其溶液加热蒸干并灼烧最终得到物质是_____________________(填化学式)。
(2)常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)·c3(OH)=1032,要使c(Cr3+)降至105mol/L,溶液的pH应调至___。
(3)物质的量浓度相同的三种溶液:①(NH4)2SO4 ②氨水 ③NH4HSO4,c(NH4+)大小顺序正确的是______。(用序号表示)
(4)常温下两种溶液:a.pH=4 NH4Cl b.pH=4盐酸溶液,其中水电离出C(H+)之比为______。
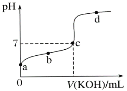
II.室温下,某一元弱酸HA的电离常数K=1.6×10-6。 向20.00 mL 浓度约为0.1 mol·L-1 HA溶液中逐滴加入0.1000 mol·L-1 的标准NaOH溶液,其pH变化曲线如图所示(忽略温度变化)。请回答下列有关问题:
(1)a、b、c、d四点中水的电离程度最大的是________点,滴定过程中宜选用________作指示剂,滴定终点在___(填“c点以上”或“c点以下”)。
(2)滴定过程中部分操作如下,下列各操作使测量结果偏高的是___________(填字母序号)。
A.滴定前碱式滴定管未用标准NaOH溶液润洗
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定
C.滴定过程中,溶液出现变色后,立即停止滴定
D.滴定结束后,仰视液面,读取NaOH溶液体积
(3)若重复三次滴定实验的数据如下表所示,计算滴定所测HA溶液的物质的量浓度为_______mol/L。(保留4位有效数字)
实验序号 | NaOH溶液体积/mL | 待测HA溶液体积/mL |
1 | 21.01 | 20.00 |
2 | 20.99 | 20.00 |
3 | 21.60 | 20.00 |
【答案】< Al3++3H2O![]() Al(OH)3+3H+ Al2O3 5 ①>③>② 106:1 c 酚酞 c点以上 A D 0.1050
Al(OH)3+3H+ Al2O3 5 ①>③>② 106:1 c 酚酞 c点以上 A D 0.1050
【解析】
I.(1)氯化铝为强酸弱碱盐,水解呈酸性,加热促进水解生成氢氧化铝和盐酸,盐酸易挥发,据此判断;
(2)根据Ksp=c(Cr3+)·c3(OH-)计算;
(3)水解和电离程度都很小,依据其它离子对铵根离子水解是否有影响分析;
(4)NH4Cl溶液中H+全部来自水的电离,盐酸中,HCl电离出H+,抑制水的电离,盐酸中的c(H+)水与溶液中的c(OH-)相等,据此解答;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离。由于酸碱恰好完全反应时溶液显碱性,据此判断指示剂以及滴定终点在图像中的位置。
(2)根据c(待测)=c(标准)·V(标准)/V(待测)分析;
(3)根据数据的有效性舍去第3组数据,利用1、2组计算消耗标准液体积的平均值,利用反应方程式HA+NaOH=NaA+H2O计算。
I.(1)氯化铝水解生成氢氧化铝和盐酸,溶液呈酸性,常温时pH<7,水解方程式为Al3++3H2O![]() Al(OH)3+3H+。水解吸热,将氯化铝溶液加热蒸干,促进氯化铝水解,平衡向右移动,盐酸挥发,得到氢氧化铝固体,灼烧得到氧化铝;
Al(OH)3+3H+。水解吸热,将氯化铝溶液加热蒸干,促进氯化铝水解,平衡向右移动,盐酸挥发,得到氢氧化铝固体,灼烧得到氧化铝;
(2)当c(Cr3+)=10-5mol/L时,Ksp=c(Cr3+)·c3(OH-)则溶液的c(OH-)=![]() mol/L=10-9 mol/L,则氢离子浓度是10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
mol/L=10-9 mol/L,则氢离子浓度是10-5mol/L,pH=5,即要使c(Cr3+)降至10-5mol/L,溶液的pH应调至5;
(3)(NH4)2SO4溶液中铵根离子浓度最大,硫酸根离子不影响铵根离子的水解,氨水中一水合氨电离程度很小,铵根离子浓度最小,硫酸氢铵中,氢离子对铵根离子的水解起到抑制作用,所以三种溶液中,铵根离子的浓度大小顺序是:①>③>②;
(4)pH=4的NH4Cl溶液中铵根水解,由水电离出的c(H+)=10-4mol/L,盐酸抑制水的电离,pH=4的盐酸溶液中由水电离出的c(H+)=10-10mol/L,二者比值为10-4mol/L:10-10mol/L=106:1;
II.(1)a点是HA溶液,b点是HA和少量NaA的混合溶液,c点是NaA和少量HA的混合溶液,d点是NaA和NaOH的混合溶液,酸、碱均能抑制水的电离,NaA水解促进水的电离,所以c点溶液中水的电离程度最大。由于酸碱恰好完全反应时溶液显碱性,故应该选择在碱性范围内变色的指示剂酚酞。根据图像可知滴定终点应在c点以上;
(2)A.碱式滴定管未用标准NaOH溶液润洗就直接注入标准溶液,标准液的浓度偏小,造成V(标准)偏大,根据c(待测)=c(标准)·V(标准)/V(待测)可以知道测定c(HA)偏大,故A正确;
B.用蒸馏水洗净锥形瓶后,立即装入HA溶液后进行滴定,被滴定的HA溶质的量不变,对结果没有影响,故B错误;
C.滴定过程中,溶液出现变色后,立即停止滴定,相当于标准液的体积偏小,根c(待测)=c(标准)·V(标准)/V(待测)可以知道测定c(HA)偏小,故C错误;
D.滴定结束后,仰视液面,读取NaOH溶液体积,造成V(标准)偏大,根据c(待测)=c(标准)·V(标准)/V(待测)可以知道测定c(HA)偏大,故D正确。
故答案为AD;
(3)根据数据的有效性舍去第3组数据,则1、2组平均消耗V(NaOH)=(21.01+


 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案科目:高中化学 来源: 题型:
【题目】在标准状况下有一定量的气体如下:①6.72LCH4、②3.01×1023个HCl分子、③13.6gH2S、④0.2molNH3,下列对这四种气体的关系从大到小排列的组合中正确的是( )
a.体积:②>③>①>④ b.密度:②>③>④>①
c.质量:②>③>①>④ d.氢原子个数:①>③>④>②
A.abcB.bcdC.abcD.abcd
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式是
A. 浓盐酸与铁屑反应:2Fe+6H+=2Fe3++3H2↑
B. 铜溶于稀硝酸:3Cu+ 8H+ +2NO3—=3Cu2+ +2NO↑ + 4H2O
C. 实验室用MnO2和浓盐酸制取Cl2:MnO2+4HCl(浓)![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
D. 稀硫酸中滴加氢氧化钡溶液:H++ OH—=H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法是一种利用离子交换膜进行海水淡化的方法,其原理如图所示,电极为惰性电极。已知海水中含Na+、Cl-、Ca2+、Mg2+、SO42—等离子。下列叙述中正确的是( )

A. A膜是阳离子交换膜
B. 通电后,海水中阴离子往b电极处移动
C. 通电后,b电极上产生无色气体,溶液中出现白色沉淀
D. 通电后,a电极的电极反应式为4OH--4e-=O2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化钙(CaO2)常用作种子及谷物的无毒性消毒剂,常温下为白色的固体,微溶于水,且不溶于乙醇、乙醚和碱性溶液,但溶于酸。
某实验小组拟探究CaO2的性质及其实验室制法。
(1)实验探究CaO2与酸的反应。
操作 | 现象 |
向盛有4 g CaO2的大试管中加入10mL稀盐酸得溶液a | 剧烈反应,产生能使带火星木条复燃的气体 |
取5 mL溶液a于试管中,滴入两滴石蕊试液 | 溶液变红,一段时间后溶液颜色明显变浅,稍后,溶液变为无色 |
①CaO2与盐酸反应的化学方程式为_______________________________。
②加入石蕊试液后溶液褪色可能是因为溶液a中存在较多的_________。
(2)用如图所示装置制备过氧化钙,其反应原理为Ca+O2![]() CaO2。
CaO2。
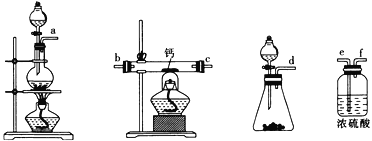
①请选择实验所需要的装置,按气流方向连接的顺序为______________________(填仪器接口的字母,上述装置可不选用也可重复使用)。
②根据完整的实验装置进行实验,实验步骤如下:Ⅰ.检验装置的气密性后,装入药品;Ⅱ.打开分液漏斗活塞,通入气体一段时间,加热药品;Ⅲ.反应结束后,_________________________________(填操作);Ⅳ.拆除装置,取出产物。
(3)利用反应:Ca2++ H2O2+2NH3+8H2O=CaO2·8H2O↓+2NH4+在碱性环境下制取CaO2的装置如图所示。

①NH3在Ca2+和H2O2的反应过程中所起的作用是______________________。
②反应结束后,经过滤、洗涤、低温烘干可获得CaO2·8H2O。过滤需要的玻璃仪器是_________;将沉淀进行洗涤的操作为_____________________________________________。
(4)设计实验证明CaO2的氧化性比FeCl3的氧化性强:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚醋酸乙烯酯E是醋酸乙烯酯D的聚合物,英文缩写为PVAc,主要用作涂料,也可用作制取聚乙烯醇和聚乙烯醇缩醛的原料。工业上可用以下合成路线制取:
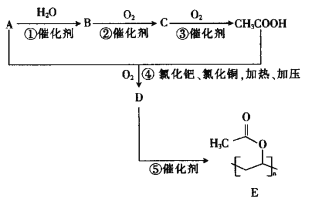
已知:A的蒸气密度相对氢气的密度是14。请回答下列问题:
(1)A的结构简式为__________,D的分子式为__________,B中官能团的名称为__________,反应⑤的反应类型为__________。
(2)完全燃烧等物质的量的A、B、C,耗氧量从大到小的顺序为__________(用字母表示)。
(3)反应④的化学方程式为________________________________________。
(4)D有多种同分异构体,既能发生水解反应,又能发生银镜反应的D的同分异构体有__________种,其中核磁共振氢谱有3组峰,且峰面积之比为1:1:4的同分异构体的结构简式为__________。
(5)根据已有知识并结合相关信息,写出以CH3CH=CH2和CH3CH2CH2OH为原料制备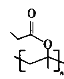 的合成路线流程图(无机试剂任用):____________________。
的合成路线流程图(无机试剂任用):____________________。
合成路线流程图示例如下:CH3CH2Br![]() CH3CH2OH
CH3CH2OH CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气中CO、NOx以及燃煤废气中的SO2都是大气污染物,对它们的治理具有重要意义。
(1)氧化还原法消除NOx的转化如下所示:NO![]() NO2
NO2![]() N2
N2
①反应Ⅰ为NO+O3===NO2+O2,生成标准状况下11.2 L O2时,转移电子的物质的量是 __________mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,氧化产物与还原产物的质量比为____。
(2)使用“催化转化器”可以减少尾气中的CO和NOx,转化过程中发生反应的化学方程式为CO+NOx→N2+CO2(未配平),若x=1.5,则方程式中CO2和N2的化学计量数之比为______。
(3)吸收SO2和NO,获得Na2S2O4和NH4NO3产品的流程图如图所示(Ce为铈元素)。
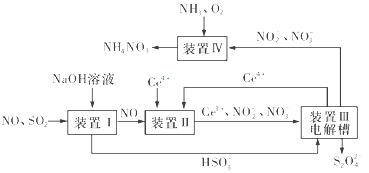
装置Ⅱ中,酸性条件下NO被Ce4+氧化的产物主要是NO3-和NO2-,请写出生成等物质的量的NO3-和NO2-时的离子方程式:________。
(4)已知进入装置Ⅳ的溶液中NO2-的浓度为a g·L-1,要使1 m3该溶液中的NO2-完全转化为NH4NO3,至少需向装置Ⅳ中通入标准状况下的氧气____L(用含a代数式表示,结果保留整数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com