
【题目】下列说法正确的是
A. 在常温下浓硫酸与铁不反应,所以可以用铁制容器来装运浓硫酸
B. 侯氏制碱工业是以氯化钠为主要原料,制得大量NaOH
C. 我国华为AI芯片已跻身于全球AI芯片榜单前列,该芯片的主要材料是二氧化硅
D. 垃圾分类是化废为宝的重要举措,厨余垃圾可用来制沼气或堆肥
科目:高中化学 来源: 题型:
【题目】碳原子数为2的烃所具有的共同性质是
A.都难溶于水,且密度比水小
B.都能使酸性 KMnO4溶液褪色
C.分子中各原子都处在同一平面内
D.都能通过加聚反应生成高分子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“没有碳,就没有生命”,这主要是因为( )
A. 碳在生物细胞中含量最多
B. 生物大分子以碳链为骨架
C. 二氧化碳是联系有机界和无机界的重要化合物
D. 碳主要分布在有机物中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机合成是制药工业中的重要手段。G是某抗炎症药物的中间体,其合成路线如下:
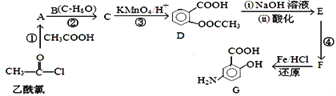
已知: ![]() ;
; ![]()
(1)B的结构简式为____________________。
(2)反应④的条件为____________________;①的反应类型为_______________;反应②的作用是____________________。
(3)下列对有机物G的性质推测正确的是____________(填选项字母)。
A.具有两性,既能与酸反应也能与碱反应
B.能发生消去反应、取代反应和氧化反应
C.能聚合成高分子化合物
D.1molG与足量NaHCO3溶液反应放出2molCO2
(4)D与足量的NaOH溶液反应的化学方程式为_____________________________________________。
(5)符合下列条件的C的同分异构体有______________种;
A.属于芳香族化合物,且含有两个甲基
B.能发生银镜反应
C.与FeCl3溶液发生显色反应
其中核磁共振氢谱有4组峰,且峰面积之比为6:2:2:1的是_____________________(写出其中一种结构简式)
(6)已知:苯环上有烷烃基时,新引入的取代基连在苯环的邻对位;苯环上有羧基时,新引入的取代基连在苯环的间位。根据体重的信息,写出以甲苯为原料合成有机物![]() 的流程图(无机试剂任选)______。合成路线流程图示例如下:X
的流程图(无机试剂任选)______。合成路线流程图示例如下:X![]() Y
Y![]() Z……目标产物
Z……目标产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL 0.1 mol/L的K2CO3溶液中逐滴加入0.1 mol/L的稀盐酸40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)的物质的量分数随溶液pH变化的情况如下图所示。下列说法正确的是

A. 随着稀盐酸的加入,溶液中![]() 保持不变
保持不变
B. 根据A点计算,Ka2 (H2CO3)的数量级为10-3
C. B 点所处的溶液中:c(K+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
D. 当pH约为8时,溶液中开始放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.纤维素属于多糖,是营养物质,但不能被人体消化吸收
B.氨基酸分子中都只含有一个氨基和一个羧基
C.金刚石和C60熔化时破坏的作用力相同
D.不发生化学变化时,物质中的化学键不可能断开
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、NH3是工业生产中的常用气体,研究其在工业上的反应过程对提高生产效率尤为重要。
I.工业上用CO和H2做原料可以合成甲醇,作为液体燃料。已知:
① 2H2(g)+CO(g) +![]() O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
O2(g) = 2H2O(g)+CO2(g) ΔH1= -594.1kJ/mol
② 2CH3OH(l)+3O2(g) = 4H2O(g)+2CO2(g) ΔH2 = -1452kJ/mol
(1)请写出用CO(g)和H2(g)合成1mol液态甲醇的热化学反应方程式:______________。
(2)一定温度下,在容积为2L的恒容容器中加入3mol H2和2mol CO,当反应2H2(g)+CO(g)![]() CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的
CH3OH(g)达到平衡时,测得容器内的压强是反应前压强的![]() ,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
,计算得该温度下反应的平衡常数K=____________。保持恒温恒容,向上述达到平衡的容器中再通入CO(g)和CH3OH(g),使得CO(g)和CH3OH(g)浓度均为原平衡的2倍,则平衡移动方向为________移动(填“正向”、“逆向”或“不”)。
II.对于氨的合成反应 N2(g)+3H2(g)![]() 2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
2NH3(g) △H<0,在密闭容器内充入0.1mol/L N2和0.3 mol/L H2。反应中NH3的物质的量浓度的变化情况如下图,试回答问题:
(3)恒容条件下,从开始反应到建立起平衡状态,v(N2)=_________;反应达到平衡后,第5分
钟末只改变反应温度,保持其它条件不变,则改变条件后NH3的物质的量浓度不可能为_____。
A. 0.20 mol/L B. 0.12 mol/L C. 0.10 mol/L D. 0.08 mol/L
(4)在第5分钟时将容器的体积缩小一半,反应在第8分钟时达到新的平衡,此时NH3的浓度约为0.30 mol/L。请在上图中画出第5分钟之后的NH3浓度的变化曲线______。
(5)其它条件不变,若只把容器改为恒压容器,加入0.2 molN2和0.6 molH2,达到平衡时,NH3的体积分数为m%。若向容器中继续加入0.2 molN2和0.6 molH2,,在同样的温度下达到平衡时,NH3的体积分数为n%,则m和n的关系正确的是______。
A.m>n B.m<n C.m=n D.无法比较%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com