
| A. | Na、Mg、Al原子最外层电子数依次增多,其简单离子的氧化性依次增强 | |
| B. | P、S、Cl最高正化合价依次升高,对应的气态氢化物的稳定性依次增强 | |
| C. | C、N、O原子半径依次增大 | |
| D. | Na、K、Rb氧化物的水化物碱性依次增强 |
分析 A.Na、Mg、Al是同周期相邻的元素,最外层分别有1、2、3个电子,原子半径逐渐变小,原子还原性越弱,其对应简单阳离子氧化性越强;
B.P、S、Cl的最高正价分别为+5、+6、+7,依次增大,元素非金属性越强,其对应的气态氢化物的稳定性越强;
C.同周期元素原子半径随原子序数的增大应而逐渐减小;
D.元素的金属性越强,其氧化物对应的水化物的碱性越强.
解答 解:A.Na、Mg、Al是同周期相邻的元素,最外层分别有1、2、3个电子,依次增多,还原性强弱关系:Na>Mg>Al,元素原子还原性越弱,其对应简单阳离子氧化性越强,故A正确;
B.P、S、Cl的最高正价分别为+5、+6、+7,依次升高,非金属性P<S<Cl,元素非金属性越强,其对应的气态氢化物的稳定性越强,故B正确;
C.C、N、O是同周期从左到右排列的元素,从左到右,原子半径逐渐减小,故C错误;
D.金属性Na<K<Rb,元素的金属性越强,其氧化物对应的水化物的碱性越强,故D正确.
故选C.
点评 主要考查非金属元素、金属元素在元素周期表中的位置关系及其性质变化规律,难度不大,注意记忆理解元素周期律.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应达到平衡状态后,各物质浓度不变,反应停止 | |
| B. | 反应达到平衡状态后,单位时间内生成1molN2的同时消耗3molH2 | |
| C. | 在上述条件下,N2不可能100%转化为NH3 | |
| D. | 使用催化剂是为了加快反应速率,提高生产效率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol过氧化钠和足量水充分反应,理论上转移的电子数约为2×6.02×1023 | |
| B. | 电工操作中将铝线与铜线直接相连,会导致铜线更快被氧化 | |
| C. | MnS悬浊液中滴加少量CuSO4溶液可生成CuS沉淀,则Ksp(CuS)<Ksp(MnS) | |
| D. | 0.1mol•L-1醋酸溶液pH=a,0.01mol•L-1醋酸溶液pH=b,则a+1<b |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Ni(OH)2 |
| 开始沉淀的pH | 1.1 | 6.5 | 3.5 | 7.1 |
| 沉淀完全的pH | 3.2 | 9.7 | 4.7 | 9.2 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molNH4Cl固体中共价键总数为5NA | |
| B. | 16gO2与O3的混合物中含有NA个氧原子 | |
| C. | 向装有催化剂的密闭容器加入3molH2和1molN2,充分反应后得2NA个氨分子 | |
| D. | 18g水(H2O)含有8NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
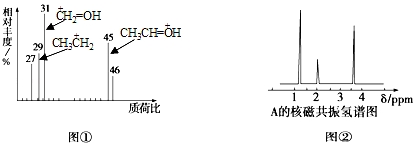
| A. | HCOOH | B. | CH3CHO | C. | CH3CH2OH | D. | CH3CH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
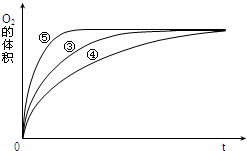 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com