
| A、v(NH3)=0.4 mol?L-1?s-1 | B、v(NH3)=1.8 mol?L-1?min-1 | C、v(N2)=0.4 mol?L-1?s-1 | D、v(H2)=0.6 mol?L-1?s-1 |
| 2 |
| 3 |


 精英口算卡系列答案
精英口算卡系列答案 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案科目:高中化学 来源: 题型:
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜的平均溶解速率 (×10-3mol-L-1?min-1) |
7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
查看答案和解析>>
科目:高中化学 来源: 题型:
某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:www.ks%5……u.com
 ⑴请将该实验的主要操作步骤补充完整:
⑴请将该实验的主要操作步骤补充完整:
①配制浓度均为 1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1的盐酸和醋酸分别移入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带 ag,并系于铜条末端,a的数值要大于 ;
④在广口瓶中装满水,按图连接好装置并检查装置的气密性;
⑤将铜条向下移动,使足量的镁带浸入酸中(铜条不与酸接触),至反应完全后,记录下 ;
⑥反应结束后,读取量筒中水的体积为V mL(包括导管中的水)。
⑵该实验中应该选用 规格的量筒。(填序号)
A. 100 mL B. 200 mL C. 500 mL
⑶若不考虑水蒸气的影响,在该实验室条件下,气体摩尔体积的计算式为 。若仰视读取量筒内水的体积,则测得气体摩尔体积将 (填偏大、偏小或不变)。
查看答案和解析>>
科目:高中化学 来源:江西省赣州十一县(市)2010届高三下学期期中联考理综化学试卷ci 题型:填空题
某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:
⑴请将该实验的主要操作步骤补充完整:
①配制浓度均为 1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1的盐酸和醋酸分别移入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带 ag,并系于铜条末端,a的数值要大于 ;
④在广口瓶中装满水,按图连接好装置并检查装置的气密性;
⑤将铜条向下移动,使足量的镁带浸入酸中(铜条不与酸接触),至反应完全后,记录下 ;
⑥反应结束后,读取量筒中水的体积为V mL(包括导管中的水)。
⑵该实验中应该选用 规格的量筒。(填序号)
A. 100 mL B. 200 mL C. 500 mL
⑶若不考虑水蒸气的影响,在该实验室条件下,气体摩尔体积的计算式为 。若仰视读取量筒内水的体积,则测得气体摩尔体积将 (填偏大、偏小或不变)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省武汉市高三二月调研测试理科综合化学试卷(解析版) 题型:填空题
目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ·mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ·mol-1
③H2O(g)=H2O(l) ΔH=-44.0 kJ·mol-1
写出CH4 (g)与NO2 (g)反应生成N2 (g) ,CO2(g)和H2O(l)的热化学方程 式_____________________
(2)用活性炭还原法处理氮氧化物。有关反应为:C(s)+2NO(g)  N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
N2(g)+CO2(g)某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T。C)条件下反应,反应进行到不同时间测得各物质的浓度如下
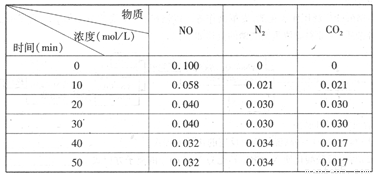
①不能作为判断反应达到化学平衡状态的依据 是_______
A.容器内CO2的浓度保持不变
B.v正(N2)=2 v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②在T。C时.该反应的平衡常数为_______(保留两位小数);
③在30 min,改变某一条件,反应重新达到平衡,则改变的条件是_______
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为:
2CO+2NO  N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。
N2+2CO2 ΔH<0 研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率.为了分别验证温度、催化剂的比表面积对化学反 应速率的影响规律、某同学设计了三组实验,部分实验条件已经填在下表中。

①上表中:a=_______,b=________,e=________
②请在给出的坐标图中,画出上表中实验II和实验III条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明相应的实验编号

查看答案和解析>>
科目:高中化学 来源: 题型:
某课外学习小组设计如下的简易实验装置,证明在相同条件下,体积相同、物质的量浓度也相同的两种强弱不同的一元酸与足量镁带反应时,生成氢气的体积相同而反应速率不同,同时测定该实验条件下的气体摩尔体积。请回答下列问题:

⑴请将该实验的主要操作步骤补充完整:
①配制浓度均为 1 mol·L-1的盐酸和醋酸溶液;
②用 量取10.00 mL 1 mol·L-1的盐酸和醋酸分别移入两个锥形瓶中;
③分别称取除去表面氧化膜的镁带 ag,并系于铜条末端,a的数值要大于 ;
④在广口瓶中装满水,按图连接好装置并检查装置的气密性;
⑤将铜条向下移动,使足量的镁带浸入酸中(铜条不与酸接触),至反应完全后,记录下 ;
⑥反应结束后,读取量筒中水的体积为V mL(包括导管中的水)。
⑵该实验中应该选用 规格的量筒。(填序号)
A. 100 mL B. 200 mL C. 500 mL
⑶若不考虑水蒸气的影响,在该实验室条件下,气体摩尔体积的计算式为 。若仰视读取量筒内水的体积,则测得气体摩尔体积将 (填偏大、偏小或不变)。
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com