
【题目】常见有机物A、B、C、D、E、G间的转化关系如下图所示(以下变化中,某些反应条件及产物未标明)。B是天然有机高分子化合物,C、D可发生银镜反应,在相同条件下,G蒸气密度是氦气的22倍。

(1)B的分子式为_____、G、的结构简式为_____。
(2)E中官能团的名称_____。
(3)A的同分异构体的结构简式_____。
(4)A→D反应的化学方程式:_____、其反应类型是_____。
【答案】(C6H10O5)n CH3COOCH2CH3 羧基 CH3OCH3 2CH3CH2OH+O2 ![]() 2CH3CHO+2H2O 氧化反应
2CH3CHO+2H2O 氧化反应
【解析】
B化学式为(C6H10O5)n;C为葡萄糖C6H12O6,在相同条件下,G蒸气密度是氦气的22倍,则G的相对分子质量为88,A与X反应生成D,D与X反应生成E,A、E反应生成G,且D能发生银镜反应,故A应为乙醇,X为氧气,D为乙醛,E为乙酸,G为乙酸乙酯,结构简式为CH3COOCH2CH3。
(1)B化学式为(C6H10O5)n;C为葡萄糖C6H12O6,在相同条件下,G蒸气密度是氦气的22倍,则G的相对分子质量为88,A与X反应生成D,D与X反应生成E,A、E反应生成G,且D能发生银镜反应,故A应为乙醇,X为氧气,D为乙醛,E为乙酸,G为乙酸乙酯,结构简式为CH3COOCH2CH3;
(2)故E中官能团为羧基;C生成A、F,为葡萄糖在酒化酶做催化剂条件下生成乙醇和二氧化碳,故F为CO2;
(3)A为乙醇,同分异构体为甲醚,结构简式为:CH3OCH3;
(4)A→D反应的化学方程式2CH3CH2OH+O2![]() 2CH3CHO+2H2O,该反应属于氧化反应。
2CH3CHO+2H2O,该反应属于氧化反应。


科目:高中化学 来源: 题型:
【题目】某无色溶液中含有的阳离子为H+、Na+、Mg2+、Al3+、Ba2+中的一种或几种,向该溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入NaOH溶液的体积的关系如图所示,由此确定原溶液中一定含有的阳离子是

A. Mg2+、Al3+、Na+ B. H+、Mg2+、Al3+ C. H+、Ba2+、Al3+ D. Ba2+、Mg2+、Al3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新鲜水果、蔬菜、乳制品中富含的维生素C具有明显的抗衰老作用,但易被空气氧化。某课外小组利用碘滴定法测某橙汁中维生素C的含量,其化学方程式如图所示,下列说法中不正确的是
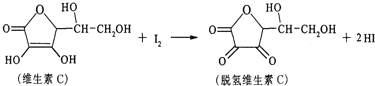
A.上述反应为氧化还原反应
B.滴定时可用淀粉溶液作指示剂
C.滴定时应剧烈振荡锥形瓶使反应充分
D.脱氢维生素C的分子式为C6H6O6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿伏加德罗常数的值用 NA 表示。下列说法中正确的是( )
A.33.6L 丙烯(标准状况)与足量 HCl 发生加成反应,生成 1-氯丙烷个数为1.5NA
B.14g 分子式为CnH2n 的链烃中含有的C—H 键的数目为 NA
C.2mol 冰醋酸与 4mol 乙醇一定条件下充分反应,生成乙酸乙酯个数为 2NA
D.1L lmol/L 的葡萄糖溶液中,溶质所含羟基的个数为 5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁及其化合物在生产、生活中应用广泛,研究铁及其化合物的应用意义重大。
(1)绿矾是一种重要的硫酸盐,其化学式为FeSO4·7H2O,某化学兴趣小组通过实验探究来测定某绿矾样品中FeSO4·7H2O的含量,步骤如下:
i.称取上述样品9.0g,配成250 mL准确浓度的FeSO4溶液;
ii.最取25.00 mL上述溶液于锥形瓶中,用0.02000 mol·L-1的酸性KMnO4溶液与之完全反应,消耗KMnO4溶液30.00 mL(杂质不与KMnO4溶液反应)。
①配制FeSO4溶液时,需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、量筒、___;配制溶液过程中未洗涤烧杯、玻璃棒,会造成所配溶液浓度____(填“偏大”、“偏小”或“无影响”)。
②步骤ii中反应的离子方程式为5Fe2++MnO4-+X=5Fe3++Mn2++4H2O,则X的化学式为______,其系数为______。
③该样品中FeSO4·7H2O的质量百分含量为____(计算结果保留1位小数)。
(2)工业上用氯化铁腐蚀铜箔制造电路板。某工程师为了从使用过的腐蚀废液中回收铜,并获得氯化铁溶液,准备采用下列步骤:
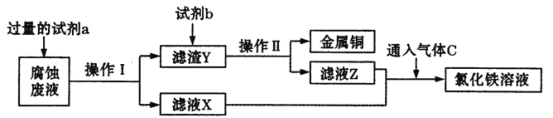
回答下列问题:
①请写出试剂a的化学式____,试剂b的名称____。
②滤液X、Z中均含有同一种溶质,它们转化为氯化铁溶液的离子方程式为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用核磁共振仪对分子式为C3H8O的有机物进行分析,核磁共振氢谱有三个峰,峰面积之比是1:1:6,则该化合物的结构简式为
A.CH3-O-CH2-CH3B.![]()
C.CH3CH2CH2OHD.C3H7OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)2·12H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料——铝灰(含Al、Al2O3及少量SiO2和FeO·xFe2O3)可制备明矾。工艺流程如下:回答下列问题:
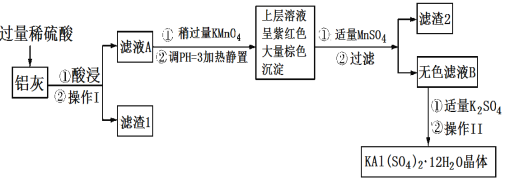
(1)明矾净水的原理是______________(用离子方程式表示)。
(2)操作Ⅰ是________,操作Ⅱ是蒸发浓缩、__________、过滤、洗涤、干燥。
(3)检验滤液A中是否存在Fe2+的试剂是__________(只用一种试剂)。
(4)将铝灰投入氢氧化钠溶液中生成气体的化学方程式是__________,在滤液A中加入高锰酸钾发生反应的离子方程式为(该条件下MnO4-转化为Mn2+):_______。
(5)已知:在pH=3、加热条件下,MnO4-可与Mn2+反应生成MnO2。加入MnSO4发生反应的离子方程式为:________,滤渣2含有的物质是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E原子序数依次增大;A与B可形成4核10电子的分子;C、E同主族,D、E同周期;C和D可形成离子化合物D2C,D2C中阴阳离子的电子层结构相同,且电子总数为30。
请回答下列问题![]() 用元素符号表示
用元素符号表示![]() :
:
(1)元素A的一种同位素质子数与中子数相等,这种同位素的符号是______。
(2)元素B在周期表中的位置是______。
(3)元素A与B形成10电子的分子,其水溶液呈碱性,用电离方程式表示______。
(4)元素A、B、C形成的原子个数比为4:2:3的盐,属于______![]() 填“离子“或“共价“
填“离子“或“共价“![]() 化合物,含有的化学键类型为______。
化合物,含有的化学键类型为______。
(5)元素C、D形成化合物D2C2的电子式为______,其与水反应的离子方程式为______。
(6)元素C、D、E、F形成简单离子的半径由小到大的顺序为______。
(7)元素E与F相比,元素原子得电子能力较强的是______,用离子方程式证明______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.宜城市鄂西化工厂以铬铁矿(主要成分为 FeO 和 Cr2O3,含有 Al2O3、SiO2 等杂质)为主要原料生产化工原料红矾钠(主要成分 Na2Cr2O7·2H2O),工艺流程如下图:

i.常温,NaBiO3不溶于水,有强氧化性,碱性条件下,能将Cr3+转化为 CrO42-。ii.
金属离子 | Fe3+ | Al3+ | Cr3+ | Fe2+ | Bi3+ |
开始沉淀的pH | 2.7 | 3.4 | 5.0 | 7.5 | 0.7 |
沉淀完全的pH | 3.7 | 4.9 | 5.9 | 9.7 | 4.5 |
(1)步骤③需加氢氧化钠溶液,此时pH要调到5的目的是__________________。
(2)写出④反应的离子方程式____________________________________。
(3)将溶液 H 经过蒸发浓缩,冷却结晶,过滤,洗涤,干燥即得红矾钠粗晶体,精制红矾钠粗晶体需要采用的操作是______________(填操作名称)。
Ⅱ.经检测鄂西化工厂的工业废水中含 5.00×10-3 mol·L-1 的 Cr2O72-,其毒性较大。该化工厂的科研人员为了变废为宝,将废水处理得到磁性材料 Cr0.5Fe1.5FeO4(Fe 的化合价依次为+3、+2),又设计了如下工艺流程:
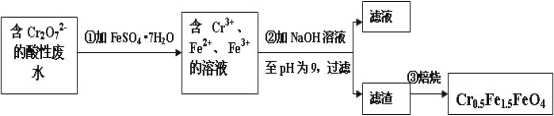
(1)第①步反应的离子方程式是_________________________________________。
(2)欲使 1L 该废水中的 Cr2O72-完全转化为 Cr0.5Fe1.5FeO4。理论上需要加入FeSO4·7H2O的质量为_________g (已知 FeSO4·7H2O 的摩尔质量为 278 g/mol)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com