
| A. | 42gC3H6中含有的共用电子对数目为8NA | |
| B. | 由6gCaCO3和5gKHCO3组成的混合物中含有的碳原子数为0.11NA | |
| C. | 标准状况下,22.4L氯气和56g铁充分反应,转移的电子数为3NA | |
| D. | 1L0.01mol•L-1Kal(SO4)2溶液中含有的阳离子数为0.02NA |
分析 A.质量换算物质的量结合分子式计算电子数;
B.碳酸钙和碳酸氢钾摩尔质量都是100g/mol,都含有1个碳原子;
C.氯气与铁反应生成氯化铁,氯气少量计算转移电子数应依据氯气的量计算;
D.根据n=cV计算出溶质硫酸铝钾的物质的量,铝离子部分水解,导致阳离子数目增多.
解答 解:A.42g C3H6中物质的量=$\frac{42g}{42g/mol}$=1mol,而1mol丙烯中含9mol共用电子对,故共用电子对数目为9nA,故A错误;
B.由6gCaCO3和5gKHCO3组成的混合物物质的量为:$\frac{11g}{100g/mol}$=0.11mol,含有的碳原子数为0.11NA,故B正确;
C.标准状况下,22.4L氯气(物质的量为1mol)和56g铁(物质的量为1mol)充分反应生成氯化铁,氯气全部反应,生成2mol氯离子,转移的电子数为2NA,故C错误;
D.1L 0.01mol•L-1 KAl(SO4)2溶液中含有0.01mol硫酸铝钾,由于铝离子部分水解,则溶液中含有的阳离子的物质的量大于0.02mol,含有的阳离子数目大于0.02 NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的应用,题目难度中等,注意掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,明确分子、原子、原子核内质子中子及核外电子的构成关系,注意盐类水解的规律.


科目:高中化学 来源: 题型:推断题
| A | C | |
| B |
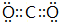 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 达平衡后降低温度,混合气体平均相对分子质量减小 | |
| B. | 使用催化剂能加快反应速率,缩短达平衡所需的时间且提高A2的转化率 | |
| C. | 达平衡后升高温度并增大压强,有可能每一组分的百分含量都不改变,但平衡常数一定发生改变 | |
| D. | 达平衡后,降低温度或减小压强都有利于该平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
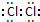 ;
;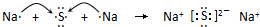 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 等体积等浓度的HA和HB两种酸分别与足量的锌反应,用排水法收集气体 | HA放出氢气的反应速率更快 | 酸性:HB<HA |
| B | 以铜、铁、浓硝酸构成原电池 | 铁表面有红棕色气泡产生 | 铜作原电池的负极 |
| C | 向25mL冷水和沸水中分别滴入5滴FeCls饱和溶液 | 前者为黄色,后者为红褐色 | 升高温度,Fe3+的水解程度增大 |
| D | 将固体CaSO4加入Na2CO3饱和溶液中 | 一段时间后,检验固体主要成分为CaCO3 | Ksp ( CaSO4)<Ksp ( CaCO3 ) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②③ | B. | ①④ | C. | ①③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I2升华 | |
| B. | NaCl颗粒被粉碎 | |
| C. | 乙醇溶于水 | |
| D. | NH4HCO3加热分解时可以闻到刺激性气味 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com