
【题目】pH=2的A、B两种酸溶液各1mL,分别加水稀释到1000mL,其溶液的pH与体积(V)的关系如图所示,则下列说法正确的是( )
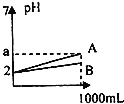
A.A、B两种酸溶液物质的量浓度一定相等
B.若a=5,则A是强酸,B是弱酸
C.稀释后A酸溶液的酸性比B酸溶液强
D.若a<5,则A.B都是弱酸且A的酸性>B
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)在基态![]() 原子中,核外电子占据的最高能级的电子云轮廓图为________形。
原子中,核外电子占据的最高能级的电子云轮廓图为________形。
(2)常见的含氮微粒有![]() 、
、![]() 、
、![]() 等。与
等。与![]() 互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知
互为等电子体的分子为________(写出一种)。根据价层电子对互斥理论,可推知![]() 的空间构型为________,
的空间构型为________,![]() 比
比![]() 更容易液化的原因是________。
更容易液化的原因是________。
(3)将足量的氨水逐滴加入到![]() 溶液中,先生成沉淀,然后沉淀溶解生成配合物
溶液中,先生成沉淀,然后沉淀溶解生成配合物![]() ,该配合物中的阳离子结构式为________;
,该配合物中的阳离子结构式为________;![]() 中的硫原子杂化方式为________;用价层电子对互斥理论解释
中的硫原子杂化方式为________;用价层电子对互斥理论解释![]() 的键角大于
的键角大于![]() :________。
:________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如图:晶胞中与Zn原子距离最近的Te原子围成________形;与Te原子距离最近的Te原子有________个;若与Zn原子距离最近的Te原子间距为apm,则晶体密度为________![]() (列出计算式即可)。
(列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究发现,反应CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
CHCl3(g)+HCl(g) ,可使CCl4(沸点77 ℃)转化为重要的化工原料CHCl3(沸点61.2 ℃),可减少其对臭氧层的破坏。(已知:该反应的副反应会生成CH2Cl2、CH3Cl和CH4等)
(1)CH4与Cl2反应时,每生成1molCCl4(g)或1molCHCl3(g)的焓变分别是△H1和△H2;H2在Cl2中燃烧,每生成1molHCl(g)产生的焓变为△H3,则:CCl4(g)+H2(g)![]() CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
CHCl3(g)+HCl(g)的△H=_____(用含有△H1、△H2和△H3的算式表示)
(2)在密闭容器中,CCl4+H2![]() CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
CHCl3+HCl达到平衡状态后,测得如下数据(假设不考虑副反应)。
实验序号 | 温度/℃ | 初始CCl4浓度/(mol·L-1) | 初始H2浓度/(mol·L-1) | CCl4的平衡转化率 |
1 | 110 | 0.8 | 1.2 | α1 |
2 | 110 | 1 | 1 | 50% |
3 | 100 | 1 | 1 | α3 |
①实验1中,CCl4的转化率α1_____50%(填“大于”“小于”或“等于”)。
②实验2中,反应进行到10h时达到平衡,在这10h内,H2的平均反应速率为_____mol· L-1·min-1。
③110 ℃时,该反应的化学平衡常数的数值为________。
④实验3中,α3的值________。
A. 等于50% B.大于50% C.小于50% D.依题所给信息无法判断
(3)120 ℃时,分别进行H
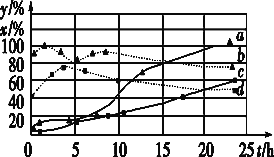
①图中表示H2起始浓度为2mol·L-1CHCl3的百分含量的变化曲线是____(填字母)。
②依图可知,有利于提高CCl4的消耗百分率和产物中CHCl3的百分含量H2的起始浓度应该为________mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】HCN(aq)+NaOH(aq)=NaCN(aq)+H2O(l) ΔH=-12.1 kJ·mol-1;
HCl(aq)+NaOH(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ·mol-1;
则HCN在水溶液中电离的ΔH等于( )
A.-69.4 kJ·mol-1B.-45.2 kJ·mol-1C.+45.2 kJ·mol-1D.+69.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成涤纶的流程图如下所示。

回答下列问题:
(1)A的名称为 ;
(2) F的结构简式是 ;
(3) C→D的反应类型是 ;F→G的反应类型为 ;
(4)E与H反应的化学方程式为 :
(5)E有多种同分异构体,符合下列条件的同分异构体有 种,其中在核磁共振氢谱中出现四组峰的是 (写出结构简式)。
①芳香族化合物;②红外光谱显示含有羧基;③能发生银镜反应;④能发生水解反应
(6) A也能一步转化生成E:![]() .试剂a可以用 溶液。
.试剂a可以用 溶液。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化碳酰胺[CO(NH2)2·H2O2]是一种与过氧化氢性质相似的固体氧化剂,因其具有价廉、安全、易于储存、使用方便等优点,被广泛应用于日用化工、食品、建筑、农业等领域。请回答下列问题:
I.过氧化碳酰胺的制备
实验室用尿素和双氧水制备过氧化碳酰胺的步骤如下:取5.0 mL 30% H2O2放入50 mL锥形瓶中,加入1.8 g尿素(H2O2与尿素的物质的量之比为3:2);将装有反应混合物的锥形瓶放入水浴锅中,水浴加热至60 °C,加热几分钟,得到一种澄清、透明的溶液;将溶液转移到大蒸发皿上,在60 °C恒温水浴锅上缓慢蒸发;溶液中缓慢析出针状晶体;当结晶完全后,将针状晶体用滤纸吸去水分,称重,得产品2.5 g。
已知:CO(NH2)2+H2O2=CO(NH2)2·H2O2。
(1)H2O2的电子式为________________________。
(2)水浴加热时温度控制在60 °C最好,其原因为___________________________。
(3)过氧化碳酰胺的产率为___________%(结果保留1位小数)。
II.过氧化碳酰胺的性质
称取0.50g过氧化碳酰胺于试管中,加5mL水溶解。
过氧化碳酰胺的鉴定反应步骤及现象如下:
在试管中加入5滴过氧化碳酰胺溶液、0.5 mL乙醚和2滴2 mol·L-1 H2SO4酸化,再加入2~3滴0.1 mol. L-1K2CrO4溶液.振荡试管,上层呈深蓝色,过氧化氢和重铬酸钾发生非氧化还原反应生成蓝色的CrO5,CrO5在乙醚中稳定,碳酰胺[CO(NH2)2]不和重铬酸钾反应,下层呈绿色,CrO5在水中不稳定,易分解生成Cr(OH)2+和O2。
(4)检验O3可用CrO3与O3反应,得蓝色晶体CrO5:CrO3+O3 →CrO5(未配平),则该反应中氧化剂与还原剂的个数比为_____________。
(5)CrO5在水中分解的离子方程式为_______________。
III.过氧化碳酰胺中活性氧含量的测定(以过氧化氢中氧原子的质量分数计)
准确称量7.5200 g产品,配制成100 mL溶液,用移液管移取10.00 mL溶液于250 mL锥形瓶中,加人适量水和硫酸,用0.1000mol·L-1的酸性高锰酸钾标准溶液平行滴定三次,平均消耗的体积为24.00mL。.
(6)配制100mL过氧化碳酰胺溶液所用到的玻璃仪器有____________,判断滴定至终点的现象为___________________,过氧化碳酰胺中活性氧含量为_____________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种全天候太阳能电池光照时的工作原理如图所示。

下列说法不正确的是( )
A.硅太阳能电池供电原理与该电池相同
B.光照时,b极的电极反应式为VO2+﹣e-+H2O=VO2++2H+
C.光照时,毎转移1mol电子,有2molH+由b极区经质子交换膜向a极区迁移
D.夜间时,该电池相当于蓄电池放电,a极发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳酸镧[La2(CO3)3]可用于治疗终末期肾病患者的高磷酸盐血症,制备反应原理为:2LaCl 3+6NH4HCO3=La2(CO3)3↓+6NH4C1+3CO2↑+3H2O,某化学兴趣小组利用下列实验装置模拟制备碳酸镧。下列说法不正确的是

A.制备碳酸镧实验流程中导管从左向右的连接顺序为:F→A→B→D→E→C
B.Y中发生反应的化学方程式为NH3·H2O+CaO=Ca(OH)2+NH 3↑
C.X中盛放的试剂是饱和NaHCO3溶液,其作用为吸收挥发的HCl,同时生成CO2
D.Z中应先通入CO2,后通入过量的NH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com