
| 选项 | 性质 | 原因 |
| A | Fe与稀HNO3、稀H2SO4反应均有气泡产生 | Fe与两种酸均发生置换反应 |
| B | 加热铝箔,熔化的铝不滴落 | 铝表面的氧化膜熔点高,包在熔化的铝外面 |
| C | 重金属盐中毒可服用牛奶解毒 | 牛奶中蛋白质变性,保护了人体的蛋白质 |
| D | 明矾用来净水 | Al3+水解生成Al(OH)3胶体,具有吸附性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、稀硝酸具有强氧化性和金属反应不能生成氢气;
B、根据金属铝在空气中被氧化为氧化铝,形成保护膜,根据氧化铝是一种高熔点的氧化物来回答;
C、根据重金属盐可以使蛋白质变性来分析;
D、明矾净水原理是电离出的铝离子水解生成氢氧化铝胶体具有吸附性;
解答 解:A、铁和稀硫酸发生置换反应,稀硝酸具有强氧化性和金属反应不能生成氢气,不能发生置换反应,故A错误;
B、铝箔在空气中被氧化为氧化铝,加热时,表面的氧化铝的熔点比铝的熔点高,包住了里边熔化的铝,所以加热铝箔的时候铝熔化了但是不会滴落,故B正确;
C、重金属盐可以是蛋白质变性,所以误食后会中毒,服用大量的蛋清和牛奶后,可以和重金属反应,变为不被吸收的物质,减弱对肠胃的影响,保护了人体的蛋白质,故C正确.
D、明矾净水原理是硫酸铝钾溶液中含有铝离子,铝离子水解Al3++3H2O?Al(OH)3(胶体)+3H+,生成氢氧化铝胶体和氢离子,氢氧化铝胶体具有吸附性净水,故D正确;
故选A.
点评 本题考查较为综合,涉及稀硝酸氧化性、明矾的净水、蛋白质性质、铝及氧化铝的性质等,侧重物质性质的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
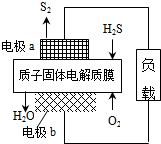 H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )
H2S废气资源化利用途径之一是回收能量并得到单质硫.反应原理为:2H2S(g)+O2(g)═S2(s)+2H2O(l)△H=-632kJ•mol-1.如图为质子膜H2S燃料电池的示意图.下列说法正确的是( )| A. | 电极a为电池的正极 | |
| B. | 电极b上发生的电极反应为:O2+2H2O+4e-=4 OH- | |
| C. | 电路中每流过4mol电子,电池内部释放632kJ热能 | |
| D. | 每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2-的离子半径大于Y+的离子半径 | |
| B. | H2Z的沸点高于H2X | |
| C. | Z的简单气态氢化物稳定性比W的强 | |
| D. | Y2X2和Y2Z的晶体类型和化学键类型完全相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2CO3→NaHCO3 | B. | Fe→FeCl2 | C. | NaCl→Na | D. | Al2O3→Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol Na2O2中所含的离子数目为3NA | |
| B. | 标况下,22.4L氯气参与的反应中,转移的电子数一定为2NA | |
| C. | 0.1mol/L Al2(SO4)3溶液中,Al3+的数目为0.2NA | |
| D. | 1molSO2与足量O2在一定条件下反应生成SO3,共转移2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、MnO4-、S2-、SO42- | B. | K+、OH-、Cl-、CO32- | ||
| C. | Ca2+、CH3COO-、Al3+、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com