
| A. | 0.30mol/l | B. | 0.225mol/l | C. | 0.45mol/l | D. | 0.36mol/l |
分析 发生反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,由反应方程式可知,NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4,x+y=0.6×0.1,据此计算x、y的值,再根据方程式计算铜离子的物质的量,根据c=$\frac{n}{V}$计算铜离子浓度.
解答 解:反应的离子方程式为:3Cu+2NO3-+8H+=3Cu2++2NO(g)+4H2O,铜足量时NO3-和H+的物质的量之比为1:4,氢离子与硝酸根恰好反应,生成的铜离子物质的量最大,
设HNO3、H2SO4各为x、ymol,则n(NO3-):n(H+)=x:(x+2y)=1:4、x+y=0.6×0.1,联立解得:x=0.024mol、y=0.036mol,
由方程式可知,生成铜离子的物质的量为:0.024mol×$\frac{3}{2}$=0.036mol,
所以铜离子的最大浓度为:$\frac{0.036mol}{0.1L}$=0.36mol/L,
故选D.
点评 本题考查离子方程式的计算、混合物反应的计算,题目难度中等,确定NO3-和H+的物质的量之比为1:4时生成的铜离子浓度最大是解题的关键,注意利用离子方程式进行解答,试题培养了学生的化学计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. |  1,4-二甲基丁 1,4-二甲基丁 | B. | 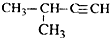 3-甲基丁炔 3-甲基丁炔 | C. | 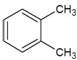 二甲基苯 二甲基苯 | D. | 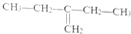 2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol固体S单质燃烧放出的热量大于293.23 kJ | |
| B. | 1mol气体S单质燃烧放出的热量小于293.23 kJ | |
| C. | 1 mol SO2(g)的键能的总和大于1 mol S(l)和1 mol O2(g)的键能之和 | |
| D. | 1 mol SO2(g)的键能的总和小于1 mol S(l)和1 mol O2(g)的键能之和 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
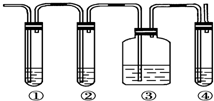 实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题:
实验室制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫.有人设计下列实验以确认上述混合气体中有乙烯和二氧化硫.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:R>Z>Y | |
| B. | X的最简单气态氢化物分子中含有18个电子 | |
| C. | Y与Z形成的常见化合物既能与酸反应,又能与碱反应 | |
| D. | 同周期元素中R的最高价氧化物对应水化物的酸性最强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1L 0.1mol/L的NaOH溶液中氧原子个数为0.1NA | |
| B. | 3g SiO2中Si-O数目为0.1NA | |
| C. | 0.1 mol钠与足量O2充分反应时,转移的电子数为0.1NA | |
| D. | 0.2 mol SO2与0.1mol O2充分反应,产物的分子数为0.1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫酸与氢氧化钡溶液反应:H++OH-═H2O | |
| B. | 稀H2SO4与铁粉反应:2Fe+6H+═2Fe3++3H2↑ | |
| C. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| D. | AlCl3溶液中加入足量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com