
 ,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
,写出E与H2O反应生成A的化学方程式2Na2O2+2H2O=4NaOH+O2↑
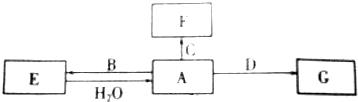
分析 A、B、C、D是常见单质,E、F、G是化合物,E的焰色呈黄色,常用作供氧剂,则E是Na2O2,过氧化钠和水反应生成单质A为O2,氧气和单质Na反应生成过氧化钠,则B是Na;F是一种红棕色粉末,常用作红色油漆和涂料,则F是Fe2O3,C是Fe;D由地壳中含量最多的金属元素组成,为Al,则G为Al2O3,
(1)E是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,O-O原子之间存在共价键;过氧化钠和水反应生成NaOH和氧气;
(2)Al和氧化铁在高温下发生铝热反应生成氧化铝和Fe,对于所有的化学反应来说,升高温度反应速率都增大;
(3)Al和NaOH溶液反应生成偏铝酸钠和氢气,该反应中水是氧化剂;
(4)n(Fe2O3)=$\frac{8.0g}{160g/mol}$=0.05mol,加入铜粉发生的离子方程式为2Fe3++Cu=2Fe 2++Cu 2+,根据铁离子和Cu之间的关系式计算.
解答 解:A、B、C、D是常见单质,E、F、G是化合物,E的焰色呈黄色,常用作供氧剂,则E是Na2O2,过氧化钠和水反应生成单质A为O2,氧气和单质Na反应生成过氧化钠,则B是Na;F是一种红棕色粉末,常用作红色油漆和涂料,则F是Fe2O3,C是Fe;D由地壳中含量最多的金属元素组成,为Al,则G为Al2O3,
(1)E是过氧化钠,过氧化钠中钠离子和过氧根离子之间存在离子键,O-O原子之间存在共价键,过氧化钠电子式为 ;过氧化钠和水反应生成NaOH和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,
;过氧化钠和水反应生成NaOH和氧气,反应方程式为2Na2O2+2H2O=4NaOH+O2↑,
故答案为: ;2Na2O2+2H2O=4NaOH+O2↑;
;2Na2O2+2H2O=4NaOH+O2↑;
(2)Al和氧化铁在高温下发生铝热反应生成氧化铝和Fe,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3,对于所有的化学反应来说,升高温度反应速率都增大,所以选③,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$2Fe+Al2O3;③;
(3)Al和NaOH溶液反应生成偏铝酸钠和氢气,离子方程式为2Al+2OH-+2H2O=+2AlO2-+3H2↑,该反应中水是氧化剂,
故答案为:2Al+2OH-+2H2O=+2AlO2-+3H2↑;水;
(4)n(Fe2O3)=$\frac{8.0g}{160g/mol}$=0.05mol,加入铜粉发生的离子方程式为2Fe3++Cu=2Fe 2++Cu 2+,根据Fe原子守恒得n(Fe3+)=2n(Fe2O3)=0.05mol×2=0.1mol,
根据铁离子和Cu之间的关系式得消耗m(Cu)=n(Cu).M(Cu)=$\frac{1}{2}$n(Fe3+).M(Cu)=$\frac{1}{2}$×0.1mol×64g/mol=3.2g,
故答案为:3.2g.
点评 本题考查无机物推断,为高频考点,涉及物质推断、反应速率影响因素、方程式的计算、铝热反应等知识点,侧重考查学生分析判断及计算能力,熟悉常见元素化合物结构和性质及各个物理量之间的关系,注意:Al和NaOH溶液反应中,NaOH既不是氧化剂也不是还原剂.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
| 相关信息 | |
| X | 单质为双原子分子.若低温蒸发液态空气,因其沸点较低可先获得X的单质 |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
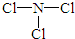 ;
;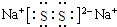 ,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .
,写出乙溶液在空气中变质过程的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2 .查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 利用溴单质的氧化性可以把碘离子转化为碘单质 | |
| B. | 实验室常用NaOH溶液吸收多余的Cl2以避免污染 | |
| C. | Cl2不能使有色布条褪色,但Cl2具有氧化性 | |
| D. | 过量的红热的铁丝在Cl2中剧烈燃烧,反应生成FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
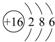
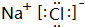 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
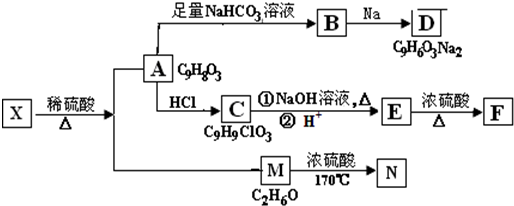
 +NaHCO3→
+NaHCO3→ +H2O+CO2↑.
+H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| Z | W | Q |
| A. | 最高正价X>Z | B. | 原子半径X>Q | C. | 单质熔点Y>Q | D. | 阴离子还原性Y>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 固态Na2O2和熔融态NaHSO4中的阴、阳离子个数比均为1:1 | |
| B. | 离子化合物中一定不含共价键 | |
| C. | 某主族元素的最高价含氧酸为HnROm,则其气态氢化物一般是H8-2m+nR或RH8-2m+n | |
| D. | 元素周期表中L层电子为奇数的元素的化合价也都是奇数 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | m:n之比为2:3 | B. | 18Om和16On的物质的量比为1:1 | ||
| C. | 18Om和16On的质量比为3:4 | D. | 18Om和16On的密度为2:3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com