
NA为阿伏加德罗常数,下列说法正确的是( )
|
| A. | 标准状况下,11.2L的戊烷所含的分子数为0.5NA |
|
| B. | 28g乙烯所含共用电子对数目为4NA |
|
| C. | 1 mol甲基的电子数目为9NA |
|
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3NA |
考点:
阿伏加德罗常数.
专题:
阿伏加德罗常数和阿伏加德罗定律.
分析:
A.标准状况下,戊烷的状态不是气体,不能使用标况下的气体摩尔体积计算其物质的量;
B.乙烯分子中含有4个碳氢共用电子对、2个碳碳共用电子对,总共含有6个共用电子对;
C.甲基中含有9个电子,1mol甲基中含有9mol电子;
D.乙烯、丙烯、丁烯的最简式为CH2,根据最简式计算出混合气体中含有的原子数.
解答:
解:A.标况下,戊烷不是气体,题中条件无法计算11.2L戊烷的物质的量及分子数,故A错误;
B.28g乙烯的物质的量为1mol,1mol乙烯中含有4mol碳氢共用电子对和2mol碳碳共用电子对,总共含有6mol共用电子对,所含共用电子对数目为6NA,故B错误;
C.1mol甲基中含有9mol电子,含有的电子数为电子数目为9NA,故C正确;
D.14g乙烯、丙烯、丁烯的混合气体中含有1mol最简式CH2,含有1mol碳原子和2mol氢原子,总共含有3mol原子,含有的原子数为3NA,故D正确;
故选CD.
点评:
本题考查阿伏加德罗常数的有关计算和判断,题目难度中等,注意明确标况下气体摩尔体积的使用条件,要求学生掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
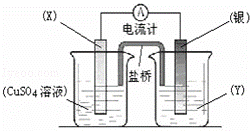
依据氧化还原反应:2Ag+(aq)+Cu(s)═Cu2+(aq)+2Ag(s)设计的原电池如图所示.
请回答下列问题:
(1)电极X的材料是 ;电解质溶液Y是 ;
(2)银电极为电池的 极,发生的电极反应为 ;X电极上发生的电极反应为 ;
(3)外电路中的电子是从 电极流向 电极.
查看答案和解析>>
科目:高中化学 来源: 题型:
如图装置,将溶液A逐滴加入固体B中,下列叙述正确的是()
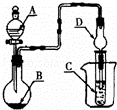
A. 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液褪色
B. 若A为醋酸,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊
C. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先产生白色沉淀后沉淀又溶解
D. 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊试液,则C中溶液先变红后褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
现有三组混合液:(1)甲酸乙酯和乙酸钠;(2)乙醇和丁醇;(3)溴化钠和单质溴的水溶液;分离以上各混合液的正确方法依次是( )
|
| A. | 分液、萃取、蒸馏 | B. | 萃取、分液、蒸馏 |
|
| C. | 萃取、蒸馏、分液 | D. | 分液、蒸馏、萃取 |
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物A分子的结构简式为: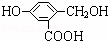
(1)A跟NaOH溶液反应的化学方程式是: ;
(2)A跟NaHCO3溶液反应的化学方程式是: ;
(3)A在一定条件下跟Na反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
镍电池广泛应用于混合动力汽车系统,电极材料由Ni(OH)2、碳粉、氧化铁等涂覆在铝箔上制成。由于电池使用后电极材料对环境有危害。某兴趣小组对该电池电极材料进行资源回收研究,设计实验流程如下:
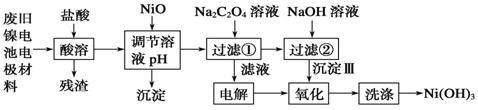
已知:①NiCl2易溶于水,Fe3+不能氧化Ni2+。
②K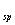 (Ni(OH)
(Ni(OH)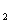 ): 5.0×10-16 , K
): 5.0×10-16 , K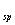 (NiC2O4): 4.0×10-10
(NiC2O4): 4.0×10-10
回答下列问题:
(1)酸溶后所留残渣的主要成份 (填物质名称)。
(2)用NiO调节溶液的pH,析出沉淀的成分为____________________(填化学式);用pH试纸测定某溶液pH的具体操作是 。
(3)写出加入Na2C2O4溶液后反应的化学方程式_____________________________。
(4)写出加入NaOH溶液所发生反应的离子方程式 ,该反应的平衡常数为 。
(5)沉淀Ⅲ可被电解所得产物 (填化学式)氧化生成Ni(OH)3 ,如何洗涤Ni(OH)3 沉淀 。
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明反应:A(g)+B(g)C(g)+D(g)已达平衡的是( )
A.混合气体的压强 B.混合气体的密度
C.B的物质的量浓度 D.气体的总物质的量
查看答案和解析>>
科目:高中化学 来源: 题型:
在一体积不变的密闭容器中发生如下化学反应:2A(g)⇌B(g)+2C(g).当物质A的起始浓度为1.0mol•L﹣1、物质B、C的起始浓度为0时,物质A的浓度、转化率以及物质B的浓度随反应时间的变化如各图所示:
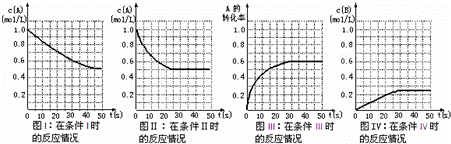
下列有关说法中正确的是( )
|
| A. | 条件Ⅰ、条件Ⅱ时的反应温度不同,压强相同 |
|
| B. | 条件Ⅰ时可能未使用催化剂,条件Ⅱ时可能使用了催化剂 |
|
| C. | 条件Ⅲ时的平衡混合物中,物质C的浓度等于0.6mol•L﹣1 |
|
| D. | 条件Ⅳ和条件Ⅱ相比较,条件Ⅳ时可能增大了反应体系的压强 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com