
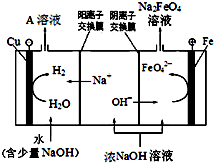
 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.分析 (1)亚铁离子能够与氢氧化钠反应生成白色沉淀氢氧化亚铁,氢氧化亚铁容易被氧化,所以观察到白色沉淀迅速变成灰绿色,最终变成红褐色,据此写出反应的离子方程式;检验亚铁离子是否变质,可以通过检验溶液中是否含有铁离子进行判断,通常使用硫氰化钾溶液;
(2)①用FeCl3、NaOH、NaClO在一定条件下反应制备Na2FeO4,氯元素化合价降低,所以生成物中有氯化钠,原子守恒判断产物中含有水,根据得失电子数守恒、原子守恒和电荷守恒来配平书写离子方程式;
②依据阳极是铁,故阳极上铁放电生成FeO42-结合碱性环境来写出电极方程式,循环使用时参加反应过程,最后又生成的物质,根据OH-在阳极被消耗,而在阴极会生成来分析.
解答 解:(1)某补铁口服液中的铁是Fe2+,某学生向其中加入NaOH溶液,发生了反应:Fe2++2OH-=Fe(OH)2↓,氢氧化亚铁在氧气和水的作用生成氢氧化铁,反应的化学方程式是:4Fe(OH)2+O2+2H2O═4Fe(OH)3,则他应该观察到的现象是:先出现白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色;氢氧化亚铁在氧气和水的作用生成氢氧化铁,反应的化学方程式是:4Fe(OH)2+O2+2H2O═4Fe(OH)3,检验亚铁离子是否变质,可以使用硫氰化钾溶液进行检验,方法为:向该口服液中加入KSCN溶液,若观察到溶液变成红色,证明亚铁离子已经变质,
故答案为:先出现白色沉淀,白色沉淀迅速变为灰绿色,最终变为红褐色;Fe2++2OH-=Fe(OH)2↓、4Fe(OH)2+O2+2H2O═4Fe(OH)3;KSCN溶液;溶液出现红色;
(2)①由于是用FeCl3、NaOH、NaClO三种物质在一定条件下反应制得Na2FeO4,故2molFeCl3失去6mol电子,被氧化为2molNa2FeO4,失去的6mol电子能被3molNaClO得到,NaClO中+1价氯元素还原为-1价,得3molCl-,加上2molFeCl3中的6molCl-,一共会生成9molNaCl;反应物中有10molNaOH,根据氢原子的守恒可知,产物中会生成5molH2O,反应的化学方程式为:2FeCl3+10NaOH+3NaClO=2Na2FeO4+5H2O+9NaCl,反应的离子方程式为:2Fe3++10 OH-+3ClO-=2FeO42-+5H2O+3Cl-,
故答案为:2Fe3++10 OH-+3ClO-=2FeO42-+5H2O+3Cl-;
②阳极是铁,故阳极上铁放电生成FeO42-,由于是碱性环境,故电极方程式为:Fe-6e-+8OH-=FeO42-+4H2O,在电解时,水电离的H+在阴极放电:2H++2e-=H2↑,c(OH-)增大,Na+通过阳离子交换膜进入阴极区,使阴极区c(NaOH)增大,故NaOH可以循环使用,故答案为:Fe-6e-+8OH-=FeO42-+4H2O;NaOH溶液.
点评 本题考查了亚铁离子、铁离子的检验方法,原电池原理和电极反应的书写方法,涉及了离子方程式的书写,题目难度中等,注意明确检验铁离子、亚铁离子的方法,掌握亚铁离子与氢氧化钠反应的离子方程式及反应现象.


科目:高中化学 来源: 题型:选择题
| A. | 向CaCl2溶液中通入CO2至过量 | |
| B. | 向AlCl3溶液中滴加氨水溶液至过量 | |
| C. | 向氢氧化铁胶体中滴加稀硫酸至过量 | |
| D. | 向Na2SiO3溶液中滴加盐酸至过量 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4Q1+0.5Q2 | B. | 4Q1+Q2+10Q3 | C. | 4Q1+2Q2 | D. | 4Q1+0.5Q2+9Q3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,1 L 0.1 mol•L-1 NH4NO3溶液中NH4+、NO3-的数目均为0.1NA | |
| B. | 标准状况下,22.4 L N2和O2的混合气体中含有的原子总数为2NA | |
| C. | 常温常压下,16 g CH4中含有共价键的数目为NA | |
| D. | 16 g CH4与18 g NH4+所含质子数均为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 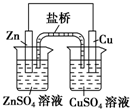 装置中,盐桥(含琼脂的饱和KCl溶液)中的K+移向ZnSO4溶液 | |
| B. | 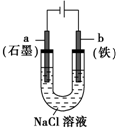 装置通电一段时间后溶液中有红褐色物质产生 | |
| C. | 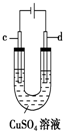 用装置精炼铜时,c极为粗铜 | |
| D. | 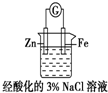 装置中电子由Zn电极沿外电路流向Fe电极,装置中有Fe2+生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氨是最重要的化工产品之一.
氨是最重要的化工产品之一.| t/℃ | 200 | 300 | 400 |
| K | K1 | K2 | 0.5 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | v(NH3)=0.010mol/(L.s) | B. | v(O2)=0.010mol/(L.s) | ||
| C. | v(NO)=0.0010mol/(L.s) | D. | v(H2O)=0.045mol/(L.s) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com