
| A. | 4 | B. | 3 | C. | 2 | D. | l |
分析 根据Na2CO3溶液与MCln盐溶液反应时,恰好将溶液中的Mn+离子完全沉淀为碳酸盐,利用化合价得出Mn+离子与nCO32-离子的关系,然后利用物质的量来计算解答.
解答 解:Na2CO3溶液中CO32-离子的物质的量为15mL×10-3×2mol•L-1=0.03mol,
MCln盐溶液中Mn+离子的物质的量为40mL×10-3×1.5mol•L-1=0.06mol,
由反应中恰好将溶液中的Mn+离子完全沉淀为碳酸盐,及M的化合价为+n,
则Na2CO3与MCln反应对应的关系式为:
2Mn+~nCO32-
2 n
0.06mol 0.03mol
则n=1,
故选D.
点评 本题考查学生利用溶液中的离子之间的反应来进行简单计算,为高频考点,侧重考查学生的分析能力,明确离子之间的关系是解答的关键,并应熟悉离子的物质的量的计算来解答即可,难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
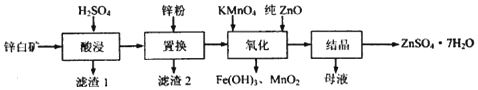
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Fe2+ | 5.8 | 8.8 |
| Zn2+ | 6.4 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | 1 | 2 | 3 |
| 实验步骤 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于空气中,观察现象 | 取一小片滤纸用淀粉碘化钾溶液湿润后,放在表面皿上,置于氧气中,观察现象 | 取少量淀粉碘化钾溶液置于试管中,通往足量的氯气,观察现象 |
| 实验现象 | 试纸缓慢变蓝 | 试纸不变蓝 | 溶液先变蓝后褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2:4:7 | B. | 4:2:7 | C. | 7:4:2 | D. | 3:5:8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
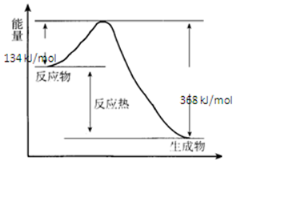 (1)下列反应中,属于吸热反应的是④⑤⑦.
(1)下列反应中,属于吸热反应的是④⑤⑦.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com