
 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:选择题
| A. | W的单质的熔点最高 | |
| B. | X元素的非金属性最强 | |
| C. | 最高价氧化物的水化物按酸性增强碱性减弱的顺序是YZWX | |
| D. | Z的原子半径最大 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
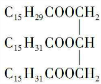 或
或 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验 序号 | 0.01mol/L KIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶 液的体积/mL | 水的体 积/mL | 实验温 度/℃ | 出现蓝色 的时间/s |
| ① | 5 | 5 | V1 | 0 | |
| ② | 5 | 5 | 40 | 25 | |
| ③ | 5 | V2 | 35 | 25 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 1min | 2min | 5min | 15min | 20min | |
| 3mol•L-1HCl | 少量气泡 | 较多气泡 | 打量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol•L-1H2SO4 | 均无明显现象(只有少量气泡) | ||||
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
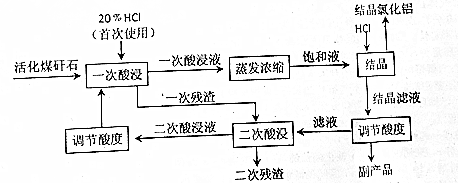
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳碳双键不可旋转所以烯烃一定有顺反异构 | |
| B. | 由乙烯、乙炔的结构特点可推知CH3-CH=C(CH3)-C≡C-CH3分子中所有的碳原子共面 | |
| C. | 甲烷和氯气反应生成一氯甲烷与苯和硝酸反应生成硝基苯的反应类型相同 | |
| D. | 苯不能使溴的四氯化碳溶液褪色,说明苯分子中没有乙烯分子中类似的碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
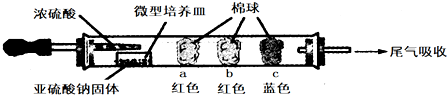
| 棉球 | 棉球上滴加的试剂 | 实验现象 | 解释和结论 |
| a | 品红试液 | 棉球变白,微热后又恢复红色 | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: 2OHˉ+SO2=SO32ˉ+H2O 或OHˉ+SO2=HSO3ˉ |
| c | 含淀粉的碘水 | 棉球变为白色 | 结论:该气体具有还原 性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com