
【题目】化学与生活密切相关,下列有关说法正确的是( )
A.淀粉、油脂和蛋白质都是高分子化合物
B.高温消毒是高温让细菌、病毒蛋白质变性死亡
C.苯酚和甲醛在酸或碱催化下生成具有绝热作用的体型高分子
D.制作航天服的聚酯纤维和用于光缆通信的光导纤维都是有机高分子材料
科目:高中化学 来源: 题型:
【题目】下列有关离子方程式,正确的是
A.稀硝酸和过量的铁屑反应:Fe+4H++NO3-=Fe3++NO↑+2H2O
B.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-![]() NH3↑+CO32-+2H2O
NH3↑+CO32-+2H2O
C.碳酸氢钠溶液水解的离子方程式:HCO3-+H2O![]() CO32-+H3O+
CO32-+H3O+
D.Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+=Fe3++3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出由甲苯制备TNT的化学反应方程式_____________________;
(2)下图是8种环状的烃类物质:

①互为同系物的有__________和__________ (填名称,下同);互为同分异构体的有__________和__________、__________和__________;
②棱晶烷的二氯取代产物有__________种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 实验室用盐酸酸化高锰酸钾溶液
B. 铁制或铝制容器可以盛装热的浓硫酸
C. 常温下,所有吸热反应都不能自发进行
D. 除去MgCl2溶液中少量FeCl3杂质,可加入足量的MgO粉末搅拌后过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).

(1)装置A中两个玻璃仪器名称分别是___________和______________ 。
(2)如何检查A装置的气密性?_______________________________________。
(3)实验时多余的氯气可用F装置来吸收,有关化学方程式是________________________。
(4)装置B中饱和食盐水的作用是____________________________。
(5)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入湿润有色布条;______________;(可供选择的用品有:无水氯化钙、碱石灰、浓硫酸)和干燥的有色布条。
(6)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入少量氯气时,可以看到无色溶液逐渐变为橙色,说明氯气的氧化性___________溴单质。(填“大于”或“小于”)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究氯气的性质,某兴趣小姐设计如下实验:
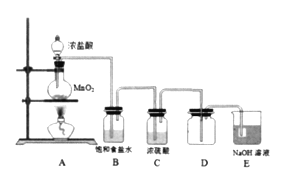
(1)装置B中饱和食盐水的作用是_________。
(2)点燃A处酒精灯,一段时间后,取出装置D,将烧红的铁丝伸入D中,可以观察到_________。
(3)有同学提出可用饱和Na2SO3溶液代替NaOH溶液吸收多余的氯气,其原因是________________(用离子方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
(1)将水蒸气通过红热的炭即可产生水煤气。反应为:
C(s)+H2O(g)![]() CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
CO(g)+H2(g) ΔH=+131.3 kJ·mol-1
能使化学反应速率加快的措施有________(填序号)。
①增加C的物质的量 ②升高反应温度
③随时吸收CO、H2转化为CH3OH ④密闭定容容器中充入CO(g)
(2)将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中,进行反应CO(g)+H2O(g)CO2(g)+H2(g),得到如下两组数据:
实验组 | 温度/℃ | 起始量/mol | 平衡量/mol | 达到平衡所需时间/min | ||
H2O | CO | H2 | CO | |||
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 2 | 4 | 0.8 | 3.2 | 3 |
①实验1中以v(CO2)表示的化学反应速率为________。
②该反应的逆反应为________(填“吸”或“放”)热反应。
(3)在一容积为2 L的密闭容器内加入2 mol的CO和6 mol的H2,在一定条件下发生如下反应:CO(g)+2H2(g) ![]() CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:
CH3OH(g) ΔH<0,该反应的逆反应速率与时间的关系如图所示:
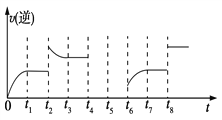
①由图可知反应在t1、t3、t7时都达到了平衡,而在t2、t8时都改变了条件,试判断t8时改变的条件可能是________。
②若t4时降压,t5时达到平衡,t6时增大反应物的浓度,请在图中画出t4~t6时逆反应速率与时间的关系曲线。________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化铜是一种黑色固体,可溶于稀硫酸。某同学想知道稀硫酸中的哪种粒子(H2O、H+、SO![]() )能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。
)能使氧化铜溶解。请你和他一起通过下图所示Ⅰ、Ⅱ和Ⅲ三个实验完成这次探究活动。

(1)通过实验Ⅰ可以证明____________________________________。
(2)要证明另外两种粒子能否溶解氧化铜,还需要进行实验Ⅱ和Ⅲ,在Ⅱ中加入稀硫酸后氧化铜溶解,则进一步确认的实验操作是:在Ⅲ中先加入________,再加入________。
(3)探究结果为_____________________________________________。
(4)反应的离子方程式为____________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com