
| 时间/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |
 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:
| 时间/s c/mol?L-1 |
0 | 20 | 40 | 60 | 80 | 100 |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0 | 0.12 | b | 0.26 | 0.30 | 0.30 |

查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(S)浓度 | 0 | 20 | 40 | 60 | 80 | 100 |
| c(A)mol?L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
| c(B)mol?L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |

| 16 |
| 3 |
| 16 |
| 3 |
 CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011
CH3CH2OH(g)+3H2O(g) 25℃时,K=2.95×1011 |
500 | 600 | 700 | 800 |
| 1.5 | 45 | 33 | 20 | 12 |
| 2.0 | 60 | 43 | 28 | 15 |
| 3.0 | 83 | 62 | 37 | 22 |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年湖北省七市(州)高三4月联考模拟试卷理综化学试卷(解析版) 题型:填空题
I.科学家一直致力于“人工固氮”的方法研究。目前合成氨的技术原理为氮气和氢气在高温高压催化剂条件下生成氨气,一定条件下,向一个2L的密闭容器中充入2molN2和6molH2,反应达平衡时生成NH3的浓度为0.5mol/L,并放出QkJ热量,该反应的热化学方程式可表示为______。
II.已知:N2O4(g)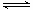 2NO2(g)
△H=+57.20kJ/mol。
2NO2(g)
△H=+57.20kJ/mol。
在1000C时,将0.100molN2O4气体充入lL恒容抽空的密闭容器中,每隔一定时间对该容器内的物质浓度进行分析得到下表数据:
|
时间(s) |
0 |
20 |
40 |
60 |
80 |
|
c(N2O4)/mol |
0.100 |
c1 |
0.050 |
c3 |
c4 |
|
c(NO2)/mol |
0.000 |
0.060 |
c2 |
0.120 |
0.120 |
(1)该反应的平衡常数表达式为______;从表中数据分析:c1 ______c2、c3______c4(选填“>”、“<”或“=”)。
(2)在右图中画出并标明此反应中N2O4和NO2的浓度随时间变化的曲线。
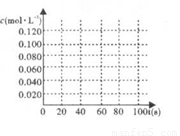
(3)在上述条件下,从反应开始至达到化学平衡时,四氧化二氮的平均反应速率为______。
(4)若起始时充入NO2气体0.200mol,则达到平衡时NO2 气体的转化率为______;其它条件不变时,下列措施能提高NO2转化率的是______ (填字母)。
A.减小NO2的浓度 B.降低温度 C.增加NO2的浓度
D.升高温度 E.再充入一定量的He
(5)向容积相同、温度分别为T1和T1的两个密闭容器中分别充入等量NO2,发生反应:2NO2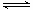 N2O4(g) (g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2
(选择A、B、C、D填空)。
N2O4(g) (g) △H=-57.20kJ/mol。恒温恒容下反应相同时间后,分别测得体系中NO2的百分含量分别为a1和a2。巳知T1<T2,则a1____a2
(选择A、B、C、D填空)。
A.大于 B.小于 C.等于 D.以上都有可能
查看答案和解析>>
科目:高中化学 来源:2010年山东省济宁二中高考化学一模试卷(解析版) 题型:解答题
| 时间/s c/mol?L-1 | 20 | 40 | 60 | 80 | 100 | |
| N2O4 | 0.20 | a | 0.10 | c | d | e |
| NO2 | 0.12 | b | 0.26 | 0.30 | 0.30 |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com