
(1)制备Na2O:4Na+2O2===2Na2O2
(2)制备Na2O2:4Na+2O2![]() 2Na2O2
2Na2O2
(3)制备Na2O:2NaNO2+6Na===4Na2O+N2↑
(4)制备Na2O2:2Na2O+O2===2Na2O2
(5)制备Na2O:Na2O2+2Na===2Na2O
科目:高中化学 来源: 题型:阅读理解

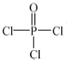 )与季戊四醇(
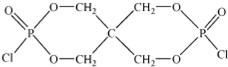
)与季戊四醇(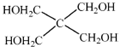 )以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.
)以物质的量之比2:1 反应时,可获得一种新型阻燃剂中间体X,并释放出一种酸性气体.季戊四醇与X 的核磁共振氢谱如图所示.

查看答案和解析>>
科目:高中化学 来源: 题型:
 Zn(OH)2+2Ag
Zn(OH)2+2Ag| 点燃 |
| ||
| 叶绿体 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
 2PbSO4+2H2O:
2PbSO4+2H2O:
| ||
| 叶绿体 |
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com