(2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(1)下列措施中,有利于降低大气中的CO
2、SO
2、NO
2浓度的有
acd
acd
填字母);
a.减少化石燃料的使用,开发新能源
b.使用无氟冰箱,减少氟里昂排放
c.多步行或乘公交车,少用专车或私家车
d.将工业废气用碱液吸收后再排放
(2)为开发新能源,有关部门拟用甲醇(CH
3OH)替代汽油作为公交车的燃料.写出由CO和H
2生产甲醇的化学方程式
CO+2H2=CH3OH
CO+2H2=CH3OH
,用该反应合成1mol液态甲醇吸收热量131.9kJ.又知,2H
2(g)+CO(g)+
O
2(g)═CO
2(g)+2H
2O(g)△H=-594.1kJ?mol
-1.请写出液态甲醇燃烧生成二氧化碳和水蒸气的热化学方程式
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1452kJ?mol-1
2CH3OH(l)+3O2(g)═2CO2(g)+4H2O(g)△H=-1452kJ?mol-1
;
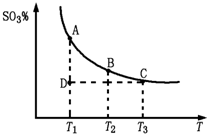
(3)硫酸工业生产中,SO
2催化氧化生成SO
3:2SO
2(g)+O
2(g)?2SO
3(g),平衡混合体系中SO
3的百分含量和温度的关系如图所示.根据图示回答下列问题:
①2SO
2(g)+O
2(g)?2SO
3(g)的△H
<
<
0(填“>”或“<”);
②若温度为T
1、T
2时,反应的化学平衡常数分别为K
1、K
2,则K
1>
>
K
2;若反应进行到状态D时,v正
>
>
v逆(填“>”、“<”或“=”).

 (2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.
(2010?泰安二模)研究碳、氮、硫的氧化物的性质对化工生产和环境保护有重要意义.

 优等生题库系列答案
优等生题库系列答案