
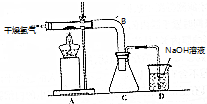
 二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.
二氯化二硫(S2Cl2)是基本有机化工的直接原料,实验室可采用干燥的氯气在110℃-140℃与硫反应,即可得S2Cl2粗品.| 物质 | S | SCl2 | S2Cl2 |
| 熔点/℃ | 112.8 | -78 | -77 |
| 沸点/℃ | 444.6 | 59.6 | 137 |

分析 (1)干燥的氯气在装置A中与硫粉加热生成S2Cl2,蒸气通过弯曲试管B的冷凝在锥形瓶中得到固体S2Cl2,并利用D装置的NaOH溶液吸收尾气中的氯气,防止环境污染;实际操作中,为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置,防止水蒸汽进入C中;
①为使S2Cl2的蒸气能快速冷凝,使用弯曲的试管B;
②为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置;S2Cl2易水解生成S、SO2和HCl,结合原子守恒可写出此反应的化学方程式;
③装置A中与硫粉加热生成S2Cl2,S2Cl2在300℃以上受热易分解,另外硫粉受热易气化,故反应需要要控制适当温度,不易太高;
④S温度较高时易气化,另外S和Cl2加热时也可能生成SCl2;为提高S2Cl2的产品纯度,可通过控制反应温度及平衡的氯气气流达到目的;
(2)①把杂质转化为沉淀或气体除去,除钙离子用碳酸根,除镁离子用氢氧根,除硫酸根用钡离子.要注意除杂质的顺序,后加的试剂最好能把前面先加是过量试剂除掉;
②向粗盐中加水溶解得到混合溶液;操作vi是从饱和NaCl溶液里分离出晶体NaCl;
③欲测定氯化钠中含碳酸钠质量分数,可通过测定一定量固体配制的溶液与足量BaCl2溶液作用生成BaCO3沉淀的质量来达到实验目的.
解答 解:(1)干燥的氯气在装置A中与硫粉加热生成S2Cl2,蒸气通过弯曲试管B的冷凝在锥形瓶中得到固体S2Cl2,并利用D装置的NaOH溶液吸收尾气中的氯气,防止环境污染;实际操作中,为避免C中S2Cl2水解,需要在C和D之间添加一个干燥装置,防止水蒸汽进入C中;①弯曲的试管B达到导气和使S2Cl2冷凝的目的,故答案为:冷凝;
②在C和D之间添加一个干燥装置,可避免C中S2Cl2水解;S2Cl2水解生成S、SO2和HCl的反应的化学方程式为:2S2Cl2+2H2O=3S+SO2+4HCl;故答案为:干燥;2S2Cl2+2H2O=3S+SO2+4HCl;
③硫粉受热易气化且S2Cl2在300℃以上受热易分解,装置A中温度高于300℃以上会导致产率偏低,故答案为:S2Cl2300℃以上完全分解;温度过高会使硫气化;
④因硫的气化及S和Cl2可能反应生成SCl2;导致装置C中收集到的S2Cl2中含有S和SCl2,为提高S2Cl2的纯度,操作时除了应控制好温度,还应注意使氧气流速平缓,故答案为:S和SCl2;使氧气流速平缓;
(2)①除去粗盐中的可溶性杂质:Mg2+、Ca2+、SO42-时,可以加入过量NaOH(去除镁离子和铁离子):Mg2++2OH-=Mg(OH)2↓,Fe3++3OH-═Fe(OH)3↓;加入过量BaCl2(去除硫酸根离子):SO42-+Ba2+=BaSO4↓;加入过量Na2CO3(去除钙离子的多余的钡离子):Ca2++CO32-=CaCO3,碳酸钠必须加在氯化钡之后,氢氧化钠和氯化钡可以颠倒加入的顺序,故答案为:BaCl2,NaOH,Na2CO3(或NaOH,BaCl2,Na2CO3);②操作i的目的是加水溶解粗盐得到混合溶液;操作vi的目的是通过过滤从饱和NaCl溶液里分离出晶体NaCl,故答案为:溶解;过滤;
③通过称取样品溶解,加过量CaCl2溶液,充分反应后过滤,将沉淀洗涤干燥后称量操作可测定氯化钠中含碳酸钠质量分数,故答案为:称取样品溶解,加过量CaCl2溶液,充分反应后过滤.将沉淀洗涤干燥后称量.
点评 本题为物质的制备与混合物的分离提纯实验探究题,涉及操作要点分析、反应原理分析等,属基础考查,对学生分析问题、解决问题的能力要求高,整体难度适中.


 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:推断题
| ① | |||||||
| ② | ③ | ④ | |||||
| ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | |||
 ,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF.
,酸性最强的物质的化学式是HClO4,气态氢化物最稳定的物质的化学式是HF. .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下1L0.1mol•L-1NH4NO3溶液中的氮原子数为0.2NA | |
| B. | 含1molH2SO4的浓硫酸和足量的锌完全反应,转移的电子数为2NA | |
| C. | A、B、C、D为短周期元素构成的四种物质,它们有如下转化关系,且D为强电解质(其他相关物质可能省略):A$\stackrel{O_{2}}{→}$B$\stackrel{O_{2}}{→}$C$\stackrel{H_{2}O}{→}$D,若A是共价化合物,0.1molA分子中含有的质子数可能为NA | |
| D. | 用足量CO还原磁铁矿得到9mol铁时转移24mol电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
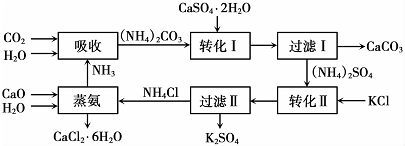
| 温度(℃) | 0 | 20 | 60 |
| K2SO4溶解得量(g) | 7.4 | 11.1 | 18.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ①②③④⑤ | C. | ①②⑤⑥⑦ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 装置 | 操作 | 现象 |
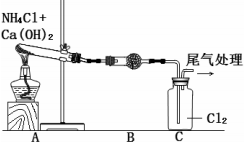 | 添加试剂,检查装置气密性,点燃酒精灯 | i.C中气体颜色变浅 ii.稍后,C中出现白烟并逐渐增多 |

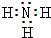 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 下列有关叙述正确的是( )
下列有关叙述正确的是( )| A. | 它有两种同分异构体 | B. | 它是平面分子 | ||
| C. | 它只有一种结构 | D. | 它有4种同分异构体 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com