
| A. | 相同温度,2N2O4(g)═4NO2(g)的反应热和化学平衡常数分别为-2△H和K2 | |
| B. | 该反应达到平衡后,缩小容器的容积,平衡右移,混合气体颜色变浅 | |
| C. | 若投入2mol NO2,通过控制外界条件,必能生成1mol N2O4 | |
| D. | 平衡时一定有v正(NO2)=2v逆(N2O4) |
分析 A.对同一可逆反应(化学计量数相同),在相同温度下,正、逆反应反应热的数值相等,符号相反,化学平衡常数互为倒数.同一反应若化学计量数变为原来的n倍,则反应热数值变为原来的n倍,平衡常数变为原来的n次幂,据此解答;
B.缩小容器的容积是增大压强,平衡正向进行,但浓度增大为主;
C.反应是可逆反应,平衡移动只是减弱不能抵消;
D.反应速率之比等于化学方程式计量数之比,为正反应速率之比.
解答 解:A.2NO2(g)?N2O4(g)△H<0,平衡常数为K,故相同温度时反应N2O4(g)?2NO2(g))△H>0,平衡常数K1=$\frac{1}{K}$,故2N2O4(g)═4NO2(g)的反应热为2△H,化学平衡常数和$\frac{1}{{K}^{2}}$,故A错误;
B.该反应达到平衡后,缩小容器的容积,压强增大平衡右移,但混合气体颜色变深,故B错误;
C.若投入2mol NO2,反应是可逆反应,平衡移动只是减弱不能抵消,生成N2O4一定小于1mol,故C错误;
D.反应速率之比等于化学方程式计量数之比,v正(NO2)=2v正(N2O4),则v正(N2O4)=v逆(N2O4),平衡时一定有v正(NO2)=2v逆(N2O4),故D正确;
故选D.
点评 本题考查了化学平衡影响因素分析,改变条件平衡向减弱这种改变的方向进行是平衡移动原理的实质,题目难度中等.


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 7:8 | C. | 8:7 | D. | 5:4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
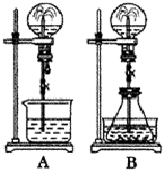 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 现象 | 结论及解释 |
 | ①A试管中黑色沉淀逐渐溶解 ②A试管上方出现红棕色气体 ③B试管中出现白色沉淀 | a.现象②说明褐色沉淀具有 还原性. b.试管B中产生白色沉淀的总反应的离子方程式为 NO2+SO2+Ba2++H2O═BaSO4↓+NO↑+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
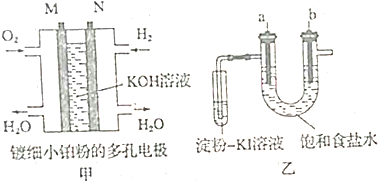
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com