
| A.放热反应中生成物总能量一定低于反应物总能量 |
| B.放热反应的反应速率总是大于吸热反应的反应速率 |
| C.盖斯定律实质上是能量守恒定律的体现 |
| D.电离平衡、水解平衡和沉淀溶解平衡均为动态平衡 |
科目:高中化学 来源:不详 题型:填空题
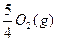 ====
====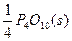
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.S(s)在O2(g)中燃烧的反应是放热反应 |
| B.S(g)+O2(g)====SO2(g);ΔH="b" kJ·mol-1,则a<b |
| C.在相同温度下,1 mol SO2(g)所具有的能量低于1 mol S(s)与1 mol O2(g)所具有的能量之和 |
| D.16 g固体硫在空气中充分燃烧,可放出148.6 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:判断题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ||
| ||
| A.56g CO和32g O2所具有的总能量大于88g CO2所具有的总能量 |
| B.12g C所具有的能量一定高于28g CO所具有的能量 |
| C.12g C和32g O2所具有的总能量大于44g CO2所具有的总能量 |
| D.将两份碳燃烧,生成CO2的反应比生成CO的反应放出的热量多 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.石墨比金刚石更稳定 |
| B.金刚石的能量比石墨的低 |
| C.金刚石比石墨稳定 |
| D.金刚石和石墨不能相互转化 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2010年上海世博会中国馆外墙使用的太阳能电池可将太阳能转化为电能 |
| B.合成氨工业中使用高效催化剂可以加快反应速率,但不能提高平衡转化率 |
| C.寻找一种催化剂能在常温下将水分解成氢气和氧气并释放能量 |
| D.笔记本电脑、手机等中使用的锂离子电池属于二次电池 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2B(g)+C(g),若A的浓度由0.1 mol·L
2B(g)+C(g),若A的浓度由0.1 mol·L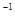 降到0.06 mol·L
降到0.06 mol·L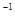 需20 s,那么由0.06 mol·L
需20 s,那么由0.06 mol·L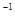 降到0.024 mol·L
降到0.024 mol·L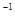 需要的时间
需要的时间查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 C2H4(g); ② CH4(g)
C2H4(g); ② CH4(g)  H2(g) + C2H4(g),
H2(g) + C2H4(g), CH4(g);△H=-x KJ· mol-1,
CH4(g);△H=-x KJ· mol-1, 1/2C2H2(g);△H=-y KJ· mol-1,
1/2C2H2(g);△H=-y KJ· mol-1,| A.x >y>z | B.x>z>y | C.y>x>z | D.z |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com