
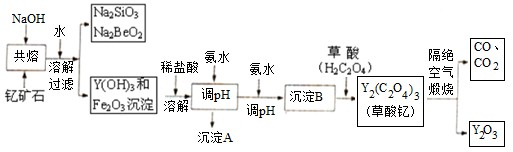
| ||
| ||


科目:高中化学 来源: 题型:
| A、NaHCO3的热稳定性大于Na2CO3 |
| B、FeCl3溶液能与铜反应,故可用于蚀刻印刷线路版 |
| C、Mg和Fe在一定条件下与水反应都生成氢气和对应的碱 |
| D、由于铝在空气中不会锈蚀,故铝制品的使用寿命都很长 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:
Na、Fe、Cu、Al是常见的金属元素,请按要求回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:

| 充电 |
| 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
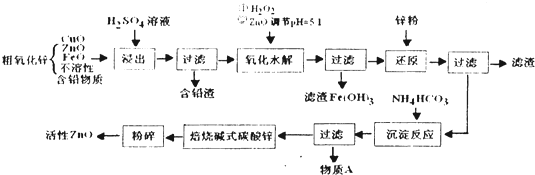
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、14.4 g?L-1 |
| B、8 g?L-1 |
| C、5.6 g?L-1 |
| D、7.2 g?L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl>SiO2>CO2 |
| B、CO2>NaCl>SiO2 |
| C、SiO2>NaCl>CO2 |
| D、SiO2>CO2>NaCl |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com