
| A. | 使用容量瓶前需检查它是否漏水 | |
| B. | 将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切 | |
| C. | 配制溶液时,用量筒量取试样后直接倒入容量瓶中,缓慢加入蒸馏水至刻度线 | |
| D. | 定容后盖好瓶塞,反复上下颠倒,摇匀 |
分析 根据溶液的配制的基本操作和容量瓶的使用注意事项:容量瓶前需检查它是否漏水来,容量瓶只能用来配制溶液,不能在容量瓶中溶解或稀释,将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切,分析.
解答 解:A.容量瓶前需检查它是否漏水,故A正确;
B.容量瓶只能用来配制溶液,不能在容量瓶中溶解或稀释,将蒸馏水注入容量瓶中,液面离刻度线下1-2cm时,改用胶头滴管滴加至液面与刻度线相切,故B正确;
C.量筒量取后应先在小烧杯中稀释,然后将洗涤液一并转入容量瓶,故C错误;
D.定容后需要上下摇匀,故D正确.
故选C.
点评 本题考查了一定物质的量浓度溶液的配制的基本操作和容量瓶的使用注意事项,属于基础型题目,难度不大.


 天天向上口算本系列答案
天天向上口算本系列答案科目:高中化学 来源: 题型:选择题

| A. | 当该卤代烃发生取代反应时,被破坏的键是①和③ | |
| B. | 当该卤代烃发生消去反应时,被破坏的键是①和③ | |
| C. | 当该卤代烃发生水解反应时,被破坏的键② | |
| D. | 当该卤代发生消去反应时,被破坏的键是①和② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图为两套实验装置.
如图为两套实验装置.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
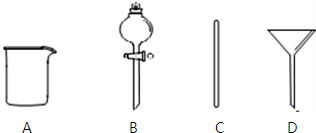 实验室需要0.1mol•L-1NaOH溶液480mL.
实验室需要0.1mol•L-1NaOH溶液480mL.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
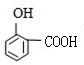 .
.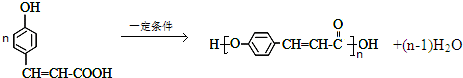 .
. .
.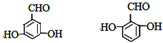 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
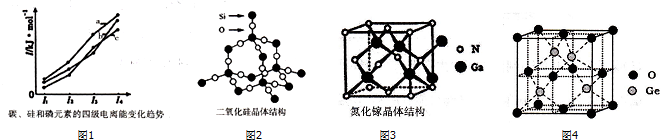
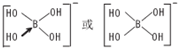 ,
,查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com