
【题目】某学生想制作一种家用环保型消毒液发生器,用石墨作电极电解饱和氯化钠溶液,通电时,为使Cl2被完全吸收,设计了如图的装置。试回答下列问题:

(1)电源中电极a的名称是__________。(正极、负极)
(2)氯气被吸收时所发生反应的化学方程式为_______________。
(3)检验Cl2是否吸收完全,可采用的方法是______________。
(4)研究表明,当NaCl刚好电解完时,溶液中只有一种溶质,则该溶质最有可能是________________。由此可以用一个化学方程表示该容器中所发生的化学反应,该化学方程式为_______________。
(5)NaCl中往往含有CaCl2、MgSO4杂质,为了除去上述杂质,可选用A:BaCl2、B:Na2CO3、C:NaOH、D:HCl。
使用试剂正确的顺序为(________________________)。
【答案】 负极 2NaOH + Cl2 == NaCl + NaClO + H2O 在C处用湿润的淀粉—KI试纸检验,若试纸变蓝则说明没有吸收完全. NaClO NaCl + H2O ![]() NaClO + H2 ↑ ACBD
NaClO + H2 ↑ ACBD
【解析】试题分析:用石墨作电极电解饱和氯化钠溶液制备消毒液,其原理是将阳极产生的氯气与阴极产生的氢氧化钠反应生成次氯酸钠。通电时,为使Cl2被完全吸收,氯气应在b所连接的电极上生成,则b为电源正极,a为负极。氯气从溶液底部生成后,气泡上升与阴极生成的氢氧化钠反应生成次氯酸钠。
(1)电源中电极a的名称是负极。
(2)氯气被吸收时所发生反应的化学方程式为2NaOH + Cl2 == NaCl + NaClO + H2O。
(3)检验Cl2是否吸收完全,可采用的方法是在C处用湿润的淀粉—KI试纸检验,若试纸变蓝则说明没有吸收完全。
(4)研究表明,当NaCl刚好电解完时,溶液中只有一种溶质,则该溶质最有可能是NaClO。由此可以用一个化学方程表示该容器中所发生的化学反应,该化学方程式为NaCl + H2O ![]() NaClO + H2 ↑ 。
NaClO + H2 ↑ 。
(5)为防止此入杂质,NaCl中的Mg2+通常用NaOH溶液沉淀,SO42-通常用BaCl2溶液沉淀,Ca2+通常用Na2CO3溶液沉淀。为了将杂质完全除去,除杂试剂要稍稍过量,而过量的试剂也要除去,所以Na2CO3溶液一定要在BaCl2溶液之后加,等杂质离子全部沉淀后,过滤,向滤液中加盐酸除去过量的氢氧化钠和碳酸钠。所以使用试剂正确的顺序可以是(ACBD或ABCD或CABD )。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在一个氧化还原反应体系中反应物、生成物共六种粒子,Fe3+、NO![]() 、Fe2+、NH
、Fe2+、NH![]() 、H+和H2O,下列叙述正确的是( )
、H+和H2O,下列叙述正确的是( )
A.该反应说明Fe(NO3)2溶液不宜加酸酸化
B.该反应中氧化剂与还原剂物质的量之比为8∶1
C.若有1 mol NO![]() 发生氧化反应,则转移电子5 mol
发生氧化反应,则转移电子5 mol
D.若将该反应设计成原电池,则负极反应为Fe3++e-===Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ZrO2常用作陶瓷材料,可由锆英砂(主要成分为ZrSiO4,也可表示为ZrO·SiO2, 还含少量Fe2O3、A12O3、SiO2等杂质)通过如下方法制取。
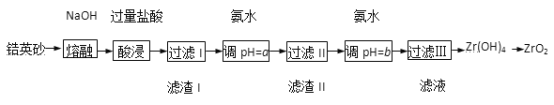
已知:ZrO2能与烧碱反应生成可溶于水的Na2ZrO3,Na2ZrO3与酸反应生成ZrO2+。
(1)在熔融时NaOH和ZrSiO4发生反应的化学方程式为________________,滤渣I的化学式为_______。
(2)用氨水调pH=a是为了使滤液I的杂质离子_______(填离子符号)完全沉淀,而ZrO2+不沉淀;继续加氨水至pH=b时,所发生反应的离子方程式为____________________________。
(3)过滤III所得滤液含有NH4Cl,向其中加入CaCO3粉末并加热,可得到两种气体。该反应的离子方程式为_______________。
(4)为得到纯净的ZrO2,Zr(OH)4需要洗涤,检验Zr(OH)4是否洗涤干净的方法是______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用下列方法测定某水样中O2的含量。
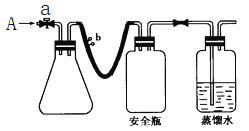
(1)实验原理
①用如图所示装置,使溶解在水中的O2在碱性条件下将Mn2+氧化成MnO(OH)2,反应的离子方程式为_____________________________。
②在酸性条件下,再用I-将生成的MnO(OH)2,还原为Mn2+,反应的离子方程式为_____________________________。然后用Na2S2O3标准溶液滴定生成的I2,反应方程式为I2+2 Na2S2O3=2Na1+Na2S4O6。
(2)实验步骤
①打开止水夹a和b,从A处向装置内鼓入过量N2,此操作的目的是___________________________;
②用注射器抽取某水样20. 00mL从A处注入锥形瓶;
③再分别从A处注入含m mol NaOH溶液及过量的MnSO4溶液;
④完成上述操作后,关闭a、b,将锥形瓶中溶液充分振荡;
⑤打开止水夹a、b,分别从A处注入足量NaI溶液及含n mol H2SO4的硫酸;
⑥重复④的操作;
⑦取下锥形瓶,向其中加入23滴_______作指示剂;
⑧用0.005 mol L -1 Na2S2O3溶液滴定至终点。滴定终点的现象是___________________________。
(3)数据分析
①若滴定过程中消耗的Na2S2O3标准溶液体积为3.90 mL,则此水样中氧(O2)的含量为________ mg L-1。
②若未用Na2S2O3标准溶液润洗滴定管,则测得水样中O2的含量将_________ (填“偏大”“偏小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将氯气通入到水中所发生反应的化学方程式为______________________。已知生成物之一是一种弱酸,试写出该物质在水溶液中的电离方程式______________。某同学将有色布条浸泡在新制的氯水中,发现布条很快被漂白。对此他认为可能是因为氯水中含有某种粒子使布条褪色,于是他提出如下的假设,请你帮他设计实验方案以验证他的假设。
编号 | 假设原因 | 验证方案 |
1 | 可能是因为Cl2分子 | A:_____________ |
2 | 可能是因为H+ | B:_____________ |
3 | 可能是因为Cl- | C:_____________ |
4 | 可能是因为HClO | ———————————————— |
5 | 可能是因为ClO- | D:_____________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.氧化镁熔点很高,可作为优质的耐高温材料
B.有色玻璃就是某些胶态金属氧化物分散于玻璃中制成
C.溴化银可用于感光材料,也可用于人工降雨
D.分子筛可用于物质分离,还能作干燥剂和催化剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A.向鸡蛋清溶液中加入硫酸铜溶液,鸡蛋清凝聚,蛋白质变性
B.氨基酸种类较多,分子中都含有-COOH和-NH2
C.纤维素、淀粉和蔗糖等天然高分子化合物在一定条件下都能发生水解
D.油脂皂化反应实质就是酯在碱性环境下发生水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三位科学家保罗·克拉兹等因在氟利昂和臭氧层方面的工作获得诺贝尔化学奖,他们的研究揭示了大气中臭氧层被破坏的机理,如下图所示:

下列说法不正确的是( )
A.氯原子在反应中做催化剂 B.过氧化氯的结构式为:O—Cl—Cl—O
C.臭氧分子最终转变成氧气分子 D.过程②中一氧化氯断键形成过氧化氯
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com