
甲、乙、丙三位同学设计了基本相同的实验检验![]() 离子.甲的实验如下:
离子.甲的实验如下:
![]()
甲由此得出了溶液A中含有![]() .乙认为甲的实验欠严谨,他的实验如下:
.乙认为甲的实验欠严谨,他的实验如下:
![]()
这样才能证明溶液B中含有![]() .丙认为乙的实验也欠严谨,他设计了一种只用BaCl2溶液与盐酸检验C(无色溶液)中是否含有
.丙认为乙的实验也欠严谨,他设计了一种只用BaCl2溶液与盐酸检验C(无色溶液)中是否含有![]() 的实验方案.经研究,在现行中学化学知识范围内丙的设计是正确的.
的实验方案.经研究,在现行中学化学知识范围内丙的设计是正确的.
(1)试样A中除![]() 外,可能含有________离子.(只填一种)
外,可能含有________离子.(只填一种)
(2)试样B中除![]() 外,可能含有________离子.(只填一种)
外,可能含有________离子.(只填一种)
(3)写出丙设计的实验步骤和实验现象.(括号内填实验步骤,方框内填实验现象)
![]()
以上即证明试样C中的![]() 离子存在.
离子存在.
科目:高中化学 来源:2012-2013学年江苏省江都市大桥中学高一下学期期末考试化学试卷(带解析) 题型:计算题
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。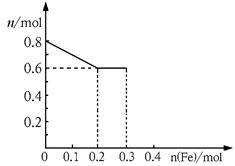
查看答案和解析>>
科目:高中化学 来源:2012-2013年安徽舒城晓天中学高三上学期重点班半月考化学试卷(带解析) 题型:计算题
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。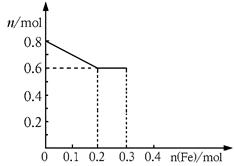
查看答案和解析>>
科目:高中化学 来源:2015届江苏省江都市高一下学期期末考试化学试卷(解析版) 题型:计算题
有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。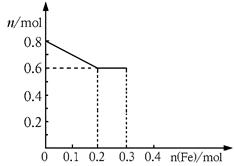
查看答案和解析>>
科目:高中化学 来源:2013届安徽舒城晓天中学高三上学期重点班半月考化学试卷(解析版) 题型:计算题
(10分)有三份不同质量的铁粉样品①②③,甲、乙、丙三位同学各取一份样品分别与含有0.8molHNO3的稀硝酸反应,反应后硝酸和铁均无剩余,且硝酸的还原产物只有NO。据此回答下列问题:
(1)甲取样品①,反应后的溶液中铁只以Fe3+离子的形式存在,则样品①的质量为 g。
(2)乙取样品②,反应后的溶液中既含有Fe3+、又含有Fe2+离子,则样品②的质量(设为ag)范围是 。
(3)丙取样品③,将其慢慢加入到稀硝酸中,并不断搅拌,反应过程中溶液里Fe3+、Fe2+、NO3—三种离子中的两种离子的物质的量的变化曲线如下图所示,则该曲线表示的是
物质的量变化的曲线,请你在此图中再画出另外种离子的物质的量的变化曲线。
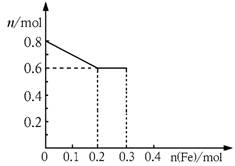
查看答案和解析>>
科目:高中化学 来源:江苏省2010-2011学年高三化学一轮过关测试(8) 题型:实验题
(10分)实验室中用浓盐酸与MnO2制取Cl2,再用Cl2和Ca(OH)2反应制少量漂白粉。已知Cl2和Ca(OH)2制漂白粉是放热反应,温度稍高易发生副反应:
6Cl2+6Ca(OH)2=Ca(ClO3)2+5CaCl2+6H2O。现有三位同学分别设计的三套实验装置如下(U形管中放有玻璃纤维,气体能顺利通过):
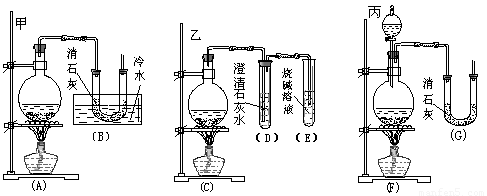
(1)请从以下六方面对上述甲、乙、丙三套装置的优缺点进行评价,将适当的选项序号填于下表内:
a.不易控制反应速率 b.容易控制反应速率 c.有副反应发生
d.可防止副反应发生 e.容易污染环境 f.可防止污染环境
|
|
优点 |
缺点 |
|
甲装置 |
|
|
|
乙装置 |
|
|
|
丙装置 |
|
|
(2)请从甲、乙、丙三套装置中,选取合理的组成部分(A、B、C、D、E、F、G),组装一套你认为更完善的实验装置,连接顺序(按气流从左到右的方向)为 ;在此装置及甲、乙、丙三装置中,你认为是否还缺少必要的装置,并说明原因
。
(3)如果反应前加入了m g Ca(OH)2,反应结束并冷却后倒出固体物质称量为n g(设反应中产生的水仍留在固体物质中)。则该固体物质中Ca(ClO)2的质量分数的表达式为(不必化简): 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com