
分析 根据n=$\frac{m}{M}$计算4g NaOH的物质的量,再根据c=$\frac{n}{V}$计算溶液物质的量浓度,溶液是均一的,取出溶液、剩余溶液的浓度均与原溶液浓度相等.
解答 解:4g NaOH的物质的量为$\frac{4g}{40g/mol}$=0.1mol,解在10mL水中,再稀释成1L,稀释后NaOH溶液物质的量浓度为$\frac{0.1mol}{1L}$=0.1mol/L,溶液是均一的,取出10mL溶液与原溶液浓度相等,即从稀释后溶液中取出10mL溶液的物质的量浓度为0.1mol/L,
故答案为:0.1mol/L.
点评 本题考查物质的量浓度计算、溶液性质,比较基础,注意对公式的理解与灵活应用.


科目:高中化学 来源: 题型:解答题

| 物质 | 相对分子质量 | 密度(g/cm-3) | 沸点/℃ |
| 苯酚 | 94 | 1.0722 | 182 |
| 丙酮 | 58 | 0.7898 | 56.5 |
| 异丙苯 | 120 | 0.8640 | 153 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 物质 | 熔点/℃ | 沸点/℃ |
| PCl3 | -112 | 75.5 |
| POCl3 | 2 | 105.3 |
| 实验步骤 | 实验现象 | 实验结论 |
| ① | 溶液X中含有Na+ | |
| ② | 溶液X中含有Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
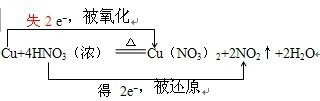 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3溶于水所得溶液能导电,据此可判断NH3属于电解质 | |
| B. | 某气体只含 N、H 两种元素,且质量之比为 14:3,则该气体一定为纯净物 | |
| C. | 氨气和氯化氢气体混合后生成的NH4Cl是离子化合物,因此该反应为离子反应 | |
| D. | 尽管 NO2能与水反应生成硝酸,但 NO2不属于酸性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、H+、SO42- | B. | H+、Ba2+、Cl-、NO3- | ||
| C. | Ba2+、Na+、OH-、NO3- | D. | Na+、Mg2+、NO3-、OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com