


科目:高中化学 来源: 题型:
| A、同素异形体:H、D、T |
| B、同系物:CH3CH2CH=CH2、(CH3)2C=C(CH3)2 |
| C、同位素:C(金刚石)、C(石墨) |
| D、同分异构体:淀粉、纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、pH=0的溶液:Fe3+、Ag(NH3)2+、NO3-、SO42- |
| B、滴加石蕊试液显蓝色的溶液:K+、Al3+、NO3-、F- |
| C、c(H+)<c(OH-)的溶液中:Na+、K+、SO32-、S2O32- |
| D、某酸性溶液:Ca2+、HCOO-、MnO4-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
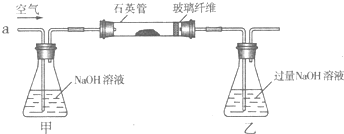 【化学--选修2化学与技术】
【化学--选修2化学与技术】
| ||

查看答案和解析>>
科目:高中化学 来源: 题型:

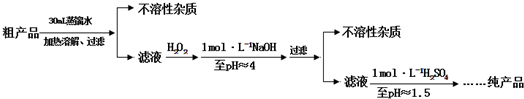

| 温 度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ |
| CuSO4?5H2O | 23.1 | 32.0 | 46.4 | 61.8 | 83.8 |
| Cu(NO3)2?6H2O | 81.8 | 125.1 | |||
| Cu(NO3)2?3H2O | 160 | 178.5 | 208 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、间二甲苯和乙苯 |
| B、2-甲基2,4-己二烯和3,4-二甲基-1-戊炔 |
| C、2,2,3-三甲基戊烷和3-乙基己烷 |
| D、2-甲基丙烯酸和甲酸正丙酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新制氯水中滴加NaOH溶液后,黄绿色褪去Cl2+2OH-=Cl-+ClO-+H2O |
| B、向NaHCO3溶液中滴加酚酞溶液,溶液变红HCO3-?H++CO32- |
| C、向Al2(SO4)3溶液中滴加过量氨水,生成白色沉淀Al3++3NH3?H2O=Al(OH)3↓+3NH4+ |
D、向少量苯酚钠溶液中通入少量CO2,溶液变浑浊 +CO2+H2O→ +CO2+H2O→ +NaHCO3 +NaHCO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com