
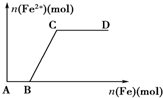
 在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )
在一定量的稀HNO3中慢慢加入铁粉,得到的Fe2+的物质的量(纵坐标)与所加铁粉的物质的量(横坐标)的关系如图所示.①Fe3+ ②Fe2+ ③Fe、Fe2+ ④Fe2+、Fe3+,下列有关说法不正确的是( )| A. | AB段铁元素以①形式存在 | B. | CD段铁元素以③形式存在 | ||
| C. | BC段铁元素以④形式存在 | D. | 以上说法均不正确 |
分析 在一定量的稀HNO3中缓慢加入铁粉,开始时反应Fe+4HNO3═Fe(NO3)3+NO↑+2H2O此时铁元素在溶液中以Fe3+存在,在B点时,硝酸恰好反应完全,即AB段;
继续加铁粉,发生Fe+2Fe3+═3Fe2+,此时溶液中Fe2+的量逐渐增多,Fe3+的量逐渐减少,即BC段;
在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,即CD段.据此分析.
解答 解:在一定量的稀HNO3中缓慢加入铁粉,开始时反应Fe+4HNO3═Fe(NO3)3+NO↑+2H2O此时铁元素在溶液中以Fe3+存在,在B点时,硝酸恰好反应完全;
继续加铁粉,发生Fe+2Fe3+═3Fe2+,此时溶液中Fe2+的量逐渐增多,Fe3+的量逐渐减少,即BC段;
在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,即CD段.
A、在一定量的稀HNO3中缓慢加入铁粉,开始发生的反应为:Fe+4HNO3═Fe(NO3)3+NO↑+2H2O,则在AB段铁元素①Fe3+以形式存在,故A正确;
B、在C点时,溶液中的Fe3+恰好完全反应,此时继续加入的铁粉不再反应,溶液中的Fe2+的量不再增多,此时铁元素以③Fe、Fe2+的形式存在,故B正确;
C、在B点时,硝酸恰好反应完全,继续加Fe,部分铁离子与Fe反应生成亚铁离子,发生反应:Fe+2Fe3+═3Fe2+,则溶液中存在④Fe2+、Fe3+,故C正确;
D、综上分析可知,ABC均正确,故D错误.
故选D.
点评 本题考查了混合物的定性分析,明确图象中每段发生的化学反应是解答本题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=1的溶液中:K+、Fe2+、MnO4-、SO42- | |
| B. | c(Fe3+)=0.1mol•L-1的溶液中:K+、ClO-、SO42-、SCN- | |
| C. | pH=12的溶液中:K+、Na+、Br-、AlO2- | |
| D. | 与铝反应生成H2的溶液中:NH4+、K+、Cl-、SiO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 非金属性:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧气、干冰、硫酸、烧碱 | B. | 碘酒、冰、盐酸、烧碱 | ||
| C. | 氢气、二氧化硫、硝酸、纯碱 | D. | 铜、硫酸钠、醋酸、石灰水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 使用催化剂是为了加快反应速率和提高SO2的转化率 | |
| B. | 达到平衡时,SO2的浓度与SO3的浓度不变 | |
| C. | 达到平衡时,v(SO2)正=v(O2)逆 | |
| D. | 为了提高SO2的转化率,应适当提高O2的浓度 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com