
����Ŀ��ijС��Ϊ̽��AgNO3��Һ�Ͳ�ͬ��������Һ��Ӧ�Ķ����ԣ��������ʵ�飺

��֪��AgSCNΪ��ɫ�����(SCN)2��±�������������ƣ�(SCN)2Ϊ��ɫ���ʡ�
��1�����еİ�ɫ������___________________��
��2�����벢ϴ�Ӣٵij������μ�0.5mol/L KI��Һ����ɫ����ת��Ϊ��ɫ�����������ӷ���ʽ���������仯____________________________��
��3�����п���������������Ӧ��_________________��
��4��ʵ��ٵ����Ŀ��_______________________��
��5�����ڢ��к�ɫ��ȥ��ԭ����Ag+��SCN����Ӧ�������С��������·�������ƣ�
��.��ͬѧ��Ϊ����ɫ��ȥ��ԭ����ƽ���ƶ�ԭ���йأ�����Ϊ_________________��
��.��ͬѧΪ��̽�������Ƿ���Ag+����SCN���ķ�Ӧ����������¶Ա�ʵ�飺

�������ɰ�ɫ��������ʱ��۲죬��Һ�ͳ�����δ������ɫ�ı䡣
��.��ͬѧ��Ϊ��������Ag+�ܹ�����SCN����Ϊ֤������룬�������ʵ����

��������ָ�뷢��ƫת��a�缫�ϲ������н�����������ʣ�b�缫��������Һ������ɫ�仯��
��ͬѧ�������֤��������ԭ��Ӧ���ŵ���___________________________��
��6��ͨ������̽�����ó�AgNO3��Һ�Ͳ�ͬ��������Һ��Ӧ�����ԵĽ�����______��
���𰸡� Ag2SO4 Ag2SO4(s) +2 I�� ===2Ag I(s) + SO42�� Ag+ + Fe2+ === Ag + Fe3+ ��2Ag+ +SO42��=== Ag2SO4 ̽�����а�ɫ��������Դ���ų�����笠���Ӱ�졣����֤��Ũ����������Ƿ����������г����Լ�笠��Ƿ��л�ԭ�ԣ��𰸺��������֣� �ֲ���Һ������ӦFe3+ + SCN- ![]() Fe(SCN)3�������Թ�ʱ����Һ�й������������������Ӧ���ɰ�ɫ����AgSCN����������������ӵ�Ũ�ȣ�����ƽ����������Һ��ɫ�� ���������ԡ���ԭ������ֱ�ӽӴ�������������Ӧ��������Ũ�ȵĽ��ͣ��������������ԡ���ԭ�Լ������ų���������������Ӵ�����������Ӱ��Ⱥ������Ը��֣� �������벻ͬ�η�Ӧ�����ͣ�������������ԭ�����빹���ε��������ӵ����ࡢ����Ũ�ȡ���Ӧ�������йأ����������������֣�
Fe(SCN)3�������Թ�ʱ����Һ�й������������������Ӧ���ɰ�ɫ����AgSCN����������������ӵ�Ũ�ȣ�����ƽ����������Һ��ɫ�� ���������ԡ���ԭ������ֱ�ӽӴ�������������Ӧ��������Ũ�ȵĽ��ͣ��������������ԡ���ԭ�Լ������ų���������������Ӵ�����������Ӱ��Ⱥ������Ը��֣� �������벻ͬ�η�Ӧ�����ͣ�������������ԭ�����빹���ε��������ӵ����ࡢ����Ũ�ȡ���Ӧ�������йأ����������������֣�
����������1��������������立�Ӧ�����������ܣ������еİ�ɫ������Ag2SO4����2�����벢ϴ�Ӣٵij���Ag2SO4���μ�0.5mol/L KI��Һ������ת��Ϊ�����ܵ�AgI����ɫ����ת��Ϊ��ɫ������Ag2SO4(s) +2 I��(aq)===2Ag I(s) + SO42��(aq)����3�����������ӵ������Ա��������ӵ�ǿ���ܽ�������Ϊ�����ӣ�����������������ӷ�Ӧ�����ܵ����������ʢ��п��ܷ��������ӷ�Ӧ�У�Ag++Fe2+=Ag+ Fe3+ ��2Ag++SO42��= Ag2SO4����4��ʵ��ٵ����Ŀ�ģ�̽�����а�ɫ��������Դ���ų�����笠���Ӱ�졣������֤��Ũ����������Ƿ����������г����Լ�笠��Ƿ��л�ԭ�ԡ�����5����.��ͬѧ��Ϊ����ɫ��ȥ��ԭ����ƽ���ƶ�ԭ���йأ���Ϊ���ֲ���Һ������ӦFe3+ + SCN- ![]() Fe(SCN)3�������Թ�ʱ����Һ�й������������������Ӧ���ɰ�ɫ����AgSCN����������������ӵ�Ũ�ȣ�����ƽ�������ƶ�����Һ��ɫ��ȥ����. ��ͬѧ�������֤��������ԭ��Ӧ���ŵ��ǣ��������벻ͬ�η�Ӧ�����ͣ�������������ԭ�����빹���ε��������ӵ����ࡢ����Ũ�ȡ���Ӧ�������йء�
Fe(SCN)3�������Թ�ʱ����Һ�й������������������Ӧ���ɰ�ɫ����AgSCN����������������ӵ�Ũ�ȣ�����ƽ�������ƶ�����Һ��ɫ��ȥ����. ��ͬѧ�������֤��������ԭ��Ӧ���ŵ��ǣ��������벻ͬ�η�Ӧ�����ͣ�������������ԭ�����빹���ε��������ӵ����ࡢ����Ũ�ȡ���Ӧ�������йء�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£�0.1 mol/L��H2C2O4��Һ��H2C2O4��HC2O4-��C2O42-��������ռ���ʵ����������ֲ�ϵ������pH�仯�Ĺ�ϵ��ͼ��ʾ�����б�������ȷ����
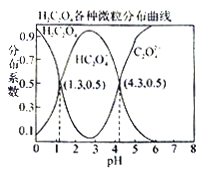
A. HC2O4-![]() H+��C2O42-��K��1��10-4.3
H+��C2O42-��K��1��10-4.3
B. �������ʵ�����NaHC2O4��Na2C2O4����ˮ�У�������ҺpHǡ��Ϊ4.3
C. ������HF��K��1��10-3.45��������H2C2O4��Һ���뵽����NaF��Һ�У������ķ�ӦΪ��H2C2O4+F-=HF��HC2O4-
D. ��0.1 mol/LNaHC2O4��Һ�У�������Ũ�ȴ�С��ϵΪ��c(Na+)��c(HC2O4-)��c(H+)��c(C2O42-)��c(OH-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£����ݻ�������ܱ������з������·�Ӧ��I2(g) + H2(g)![]() 2HI(g)���÷�Ӧ�ﵽƽ��״̬�ı�־�ǣ� ��
2HI(g)���÷�Ӧ�ﵽƽ��״̬�ı�־�ǣ� ��
A. �������������ɫ���ٸı�
B. I2��H2��HI�ķ�����֮��Ϊ1��1��2
C. I2(g) ��H2(g)��ȫת��Ϊ HI(g)
D. ��λʱ��������n mol I2��ͬʱ����n mol H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݻ������ص㣬���뷽��һ���й��ˡ��������������ѵ�ӵ�ˮ�з��������������Һ�м������Ȼ�̼������ã��ɹ۲쵽���� �� ���ſ�������������Һ��ֿ�������ʱ�õ��Ļ�ѧ������ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ�������£����Ϊ2L���ܱ������У��������·�Ӧ��N2(g)��3H2(g)![]() 2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��3min��ﵽƽ�⣬����NH3�����ʵ�����2.4 mol������
2NH3(g)����ʼʱ�������N2��H2�����ʵ����ֱ���3.0 mol��6.0 mol��3min��ﵽƽ�⣬����NH3�����ʵ�����2.4 mol������
�� 3min����N2��ʾ�Ļ�ѧ��Ӧ����Ϊ____________����H2��ת������____________��
(2)ij��ѧʵ��С���ͬѧΪ̽���ͱȽ�SO2����ˮ��Ư���ԣ���������µ�ʵ��װ�á�

a.ʵ������װ��E�Ʊ�Cl2���䷴Ӧ�Ļ�ѧ����ʽΪ��MnO2��4HCl(Ũ)![]() MnCl2��Cl2��2H2O������6 mol ��HCl�μӷ�Ӧ����ת�Ƶĵ������ʵ���Ϊ____________��
MnCl2��Cl2��2H2O������6 mol ��HCl�μӷ�Ӧ����ת�Ƶĵ������ʵ���Ϊ____________��
b.�ٷ�Ӧ��ʼһ��ʱ��۲쵽D�Թ��е�Ʒ����Һ���ֵ������ǣ�
D��_____________________________________________________________��
��ֹͣͨ�����ٸ�B��D�����Թֱܷ���ȣ������Թ��е�����ֱ�Ϊ��
B��____________________________________��D��________________________________��
c.��һ��ʵ��С���ͬѧ��ΪSO2����ˮ����Ư���ԣ�����Ϻ��Ư���Կ϶����ǿ�����ǽ��Ƶõ�SO2��Cl2��1��1ͬʱͨ�뵽Ʒ����Һ�У����������ɫЧ���������������������������������ԭ��(�û�ѧ����ʽ��ʾ)_______________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�ȷ��Ʊ�������Y��������ķ�ӦΪ��3Fe2++2S2O32��+O2+aOH���TY+S4O62��+2H2O����˵���У�����ȷ���� �� ��
A.S2O32���ǻ�ԭ��
B.Y�Ļ�ѧʽΪFe2O3
C.a=4
D.ÿ��1molO2�μӷ�Ӧ��ת�Ƶĵ�������Ϊ4mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ͼʾ���Ӧ�������������

A��ͼ1��ʾ1 L pH��2��CH3COOH��Һ��ˮϡ����V L��pH��lg V�ı仯
B��ͼ2��ʾ��ͬ�¶���ˮ��Һ��H����OH��Ũ�ȵı仯�����ߣ�ͼ���¶�T2>T1
C��ͼ3��ʾһ�������µĺϳɰ���Ӧ�У�NH3��ƽ�����������H2��ʼ�������(N2����ʼ���㶨)�ı仯��ͼ��a��N2��ת����С��b��
D��ͼ4��ʾͬһ�¶��£��ڲ�ͬ�ݻ��������н��з�Ӧ2BaO2(s)![]() 2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
2BaO(s)��O2(g)��O2��ƽ��Ũ���������ݻ��Ĺ�ϵ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л���������ȷ���ǣ� ��
A. 2-�һ����� B. 3��3-���ȶ��� C. 3��4-�������� D. 2��2-����-3-����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����l0��ʱ��10 mL 0.4 mol L��1H2O2��Һ�������ֽ⣺2H2O2![]() 2H2O��O2������ͬʱ�̲������O2�������������Ϊ��״�������±���
2H2O��O2������ͬʱ�̲������O2�������������Ϊ��״�������±���
t/min | 0 | 2 | 4 | 6 |
V(O2)/mL | 0.0 | 9.9 | 17.2 | 22.4 |
������������ȷ���ǣ���Һ����仯���Բ��ƣ�
A. 0��2 min��ƽ����Ӧ���ʱ�4��6 min��
B. 0��6 min ��ƽ����Ӧ����v(H2O2)��3.3��10��2 moL��1 L��1 min��1
C. ��Ӧ�� 6 min ʱ��c(H2O2)��0.3 mol��L��1
D. ��Ӧ��6 minʱ��H2O2�ֽ���50%
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com