
【题目】一定条件下,在体积为5 L的密闭容器中,A、B、C三种气体的物质的量n(mo1)随时间t(min)的变化如图1所示。已知达平衡后,降低温度,A的体积分数将减小。

(1)该反应的化学方程式为_____________,此反应平衡常数的表达式为K=________。
(2)该反应的反应速率v随时间t的关系如图2所示:
①根据图2判断,在t3时刻改变的外界条件是________,该反应的△H________0。(填“![]() ”、“
”、“![]() ”或“=”)
”或“=”)
②a、b、c三点中,C的体积分数最大的是________。
③各阶段的平衡常数如下表所示:
t2~t3 | t4~t5 | t5~t6 |
K1 | K2 | K3 |
K1、K2、K3之间的关系为_______(用“![]() ”、“
”、“![]() ”或“=”连接)。
”或“=”连接)。
【答案】A+2B![]() 2C
2C ![]() 升高温度 < a K1>K2=K3
升高温度 < a K1>K2=K3
【解析】
根据图1可知,A、B为反应物,且加入初始量为1mol,C为生成物,3min达到平衡状态,平衡时,A、B、C的物质的量分别为0.7mol、0.4mol、0.6mol;平衡后,降低温度,A的体积分数将减小,平衡正向移动,则正反应为放热反应。
(1)分析可知,A、B为反应物,C为生成物,反应时变化的物质的量为0.3mol、0.6mol、0.6mol,则计量数之比为1:2:2,方程式为A+2B![]() 2C;根据方程式,K=
2C;根据方程式,K=![]() ;
;
(2)①根据图像可知t3时,正、逆反应速率均增大,且逆反应速率大于正反应速率,平衡逆向移动,则改变条件为升高温度,若为增大压强时,平衡正向移动,与题意不符;升高温度平衡逆向移动,逆反应为吸热反应,则正反应为放热反应,△H<0;
②在t2时达到平衡状态,为状态a;t3时,改变外界条件,平衡逆向移动,C的体积分数减小,平衡时为状态b;t5时,改变外界条件,反应速率加快,平衡未发生移动,C的体积分数不变,为状态c,则C的体积分数大小顺序为a>b=c;
③在t2时达到平衡状态,平衡常数为K1;t3时,升高温度,正逆反应速率加快,平衡逆向移动,化学平衡常数为K2,减小;t5时,使用催化剂,反应速率加快,平衡未发生移动,化学平衡常数为K3,不变,则平衡常数的关系为K1>K2=K3。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:![]() 平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
平衡时测得A的浓度为0.50mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再达平衡时,测得A的浓度为0.30mol/L。下列有关判断正确的是
A.x+y﹤zB.平衡向正反应方向移动
C.B的转化率降低D.C的体积分数升高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题:
(1)晶体硅(熔点1410 ℃)是良好的半导体材料。由粗硅制纯硅过程如下:
![]()
在上述由SiCl4(g)制纯硅的反应中,测得每生成1.12 kg纯硅需吸收a kJ热量,写出该反应的热化学方程式:___。
(2)利用水煤气合成二甲醚的总反应为:3CO(g)+3H2(g) = CH3OCH3(g)+CO2(g) ΔH=-246.4 kJ·mol-1,它可以分为两步,反应分别如下:2CO(g)+4H2(g) = CH3OCH3(g)+H2O(g) ΔH1=-205.1 kJ·mol-1,CO(g)+H2O(g) = CO2(g)+H2(g) ΔH2=_____。已知CH3OCH3(g)的燃烧热为1455 kJ·mol-1,写出表示其燃烧热的热化学方程式:__________。
(3)用O2将HCl转化为Cl2,可提高效益,减少污染。一定条件下测得反应过程中 c(Cl2)的数据如下:
t/min | 0 | 2.0 | 4.0 | 6.0 | 8.0 |
c(Cl2)/10-3 mol/L | 0 | 1.8 | 3.7 | 5.4 | 7.2 |
计算2.0~6.0 min内HCl的反应速率为_____。
(4)在一定温度下的定容容器中,当下列物理量不再发生变化时:①混合气体的压强,②混合气体的密度,③混合气体的总物质的量,④混合气体的平均相对分子质量,⑤混合气体的颜色,⑥c(I2):c(H2):c(HI)=1:1:2,⑦氢气的百分含量。能说明I2(g)+H2(g) ![]() 2HI(g)达到平衡状态的是____。
2HI(g)达到平衡状态的是____。
(5)在恒温恒压、不做功时,反应A+B = C+D一定能自发进行的条件是ΔH__0且ΔS___0(填“<”、“>”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】痛灭定钠是一种吡咯乙酸类的非甾体抗炎药,其合成路线如图:
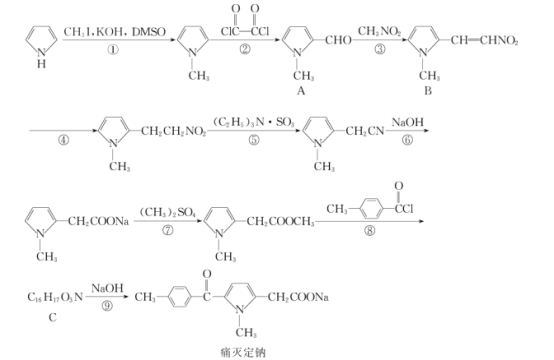
回答下列问题:
(1)化合物B中含有官能团的名称是__。
(2)化学反应①和④的反应类型分别为__和__。
(3)化合物C的结构简式为__。
(4)下列关于痛灭定钠的说法错误的是__。
a.与溴充分加成后官能团种类数不变
b.能够发生水解反应
c.核磁共振氢谱分析能够显示6个峰
d.可使溴的四氯化碳溶液褪色
e.1mol痛灭定钠与氢气加成最多消耗3molH2
(5)反应⑦的化学方程式为__。
(6)芳香族化合物X的相对分子质量比A大14,写出遇FeCl3溶液显紫色且取代基仅位于苯环对位上化合物X的结构简式:__(不考虑立体异构)。
(7)根据该试题提供的相关信息,写出由化合物![]() 及必要的试剂制备有机化合物
及必要的试剂制备有机化合物![]() 的合成路线图。__。
的合成路线图。__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.取少量卤代烃加NaOH水溶液共热,冷却,再加![]() 溶液可检验卤素原子
溶液可检验卤素原子
B.检测NaClO、![]() 等具有强氧化性物质溶液的pH时,最好选用pH试纸
等具有强氧化性物质溶液的pH时,最好选用pH试纸
C.将铂丝放在稀硫酸中洗涤并灼烧后,再蘸取待检物进行焰色反应
D.若皮肤不慎沾上少量碱液,应先用大量水冲洗,再用2%醋酸溶液或饱和硼酸溶液洗,最后用水冲洗
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA代表阿伏加德罗常数,下列说法正确的是( )
A.含有4molHCl的浓盐酸与足量MnO2反应,生成1molCl2
B.常温常压下,16gO2所含的电子数为8NA
C.标准状况下,22.4LSO3中所含的SO3分子数为NA
D.78gNa2O2与足量水充分反应时电子转移数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列四个反应:①2Na+2H2O=2NaOH +H2↑;②2Na2O2+2H2O=4NaOH+O2↑;③2F2+2H2O=4HF+O2;④2H2O![]() 2H2↑ +O2↑
2H2↑ +O2↑
(1)水只做氧化剂的是__;
(2)水只做还原剂的是__;
(3)水既做氧化剂又做还原剂的是__;
(4)水既不做氧化剂又不做还原剂的是__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种红棕色金属氧化物,B、D是金属单质,J是一种难溶于水的白色化合物,受热后容易发生分解。

请回答下列问题
(1)写出下列物质的化学式A___,E___。
(2)F在空气中转化为G的化学方程式:__。
(3)A和B反应的化学方程式:___。
(4)H和I生成J的离子方程式:___。
(5)如何检验E中大量存在的阳离子?__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】兴趣小组探究实验室中制备Cl2的过程,为证明过程中有水蒸气和HCl挥发出来,同时证明Cl2的某些性质,甲同学设计了如图所示的实验装置,按要求回答问题:

(1)若用浓盐酸与足量的MnO2反应制Cl2。MnO2+4HCl(浓)△MnCl2+Cl2↑+2H2O。
①用双线桥表示该反应的电子转移___。
②___作氧化剂 ,___作还原产物。
(2)①装置B中盛放的试剂名称为___,作用是___。
②装置D和E中出现的不同现象说明的问题是___。
③写出装置G中发生反应的离子方程式:___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com