
分析 (1)C2H5OH发生氧化反应,是原电池的负极,1mol乙醇被氧化的同时3mol的氧气被还原,而1mol氧气转移4mol的电子,正极是氧气发生还原反应,注意电解质是酸,由此分析解答;
(2)根据题给总反应式可知,H2在负极反应,氧气在正极反应,酸性条件下负极反应式为:H2-2e-═2H+;正极反应为O2+4H++4e-=2H2O;碱性条件下,负极反应为2H2-4e-+4OH-=4H2O,其正极反应为:O2+2H2O+4e-=4OH-,以此解答该题.
解答 解:(1)C2H5OH发生氧化反应,是原电池的负极,1mol乙醇被氧化的同时3mol的氧气被还原,而1mol氧气转移4mol的电子,所以每当有1mol乙醇被氧化时转移3×4=12mol,正极是氧气发生还原反应,电极反应为:O2+4H++4e-═2H2O,故答案为:负极; 12; O2+4H++4e-═2H2O;
(2)根据题给总反应式可知,H2在负极反应,氧气在正极反应,酸性条件下负极反应式为:H2-2e-═2H+;正极反应为O2+4H++4e-=2H2O;碱性条件下,负极反应为2H2-4e-+4OH-=4H2O,其正极反应为:O2+2H2O+4e-=4OH-,故答案为:H2-2e-═2H+;O2+2H2O+4e-═4OH?.
点评 本题考查原电池的工作原理,题目难度不大,注意依据原电池的原理应用,首先考虑原电池反应所依据的氧化还原反应,再考虑产物与电解质溶液的反应.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 该合金中铝的物质的量为 0.2mol | B. | 该合金中镁的物质的量为 2.4g | ||
| C. | 盐酸的物质的量浓度为 4mol/L | D. | 该反应中转移的电子数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

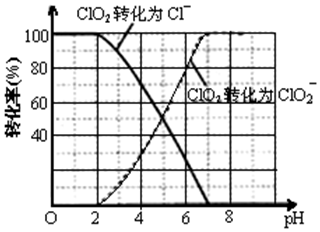
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 取样,滴加AgNO3溶液,看是否有白色沉淀生成 | |
| B. | 取样,先加盐酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 | |
| C. | 取样,加少量AgNO3溶液,有白色沉淀;再加稀硝酸,看白色沉淀是否消失 | |
| D. | 取样,先加稀硫酸酸化,再加入AgNO3溶液,看是否有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 33.3% | B. | 44% | C. | 56% | D. | 66.7% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:1 | B. | 2:1 | C. | 2:3 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | BaCl2、HCl、品红溶液 | B. | BaCl2、H2SO4、石蕊溶液 | ||
| C. | AgNO3和HNO3溶液 | D. | AgNO3和BaCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氨水与硫酸发生中和反应速率较慢 | |
| B. | 氨水使酚酞试液变浅红色 | |
| C. | 室温下,测得0.1mol/L,氨水的pH值为11.1 | |
| D. | 氨水易挥发且导电性较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 叙述 | 评价 |
| A | 乙酸乙酯在H218O中水解,产物乙醇中将含有18O | 错,根据酯的水解规律,产物乙酸中将含有18O同位素,而乙醇则没有 |
| B | 明矾和漂白粉都可用于水的净化 | 对,二者的作用原理相同 |
| C | 施肥时,草木灰(有效成分为K2CO3)不能与NH4Cl混合使用 | 对,K2CO3与NH4Cl反应生成氨气会降低肥效 |
| D | 可以用新制的Cu(OH)2悬浊液鉴别乙醇溶液、乙酸溶液和葡萄糖溶液 | 错,用新制的Cu(OH)2悬浊液不能鉴别乙醇溶液和乙酸溶液 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com