
【题目】锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱。但是氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成Zn(NH3)42+。回答下列问题:
(1)单质铝溶于氢氧化钠溶液的化学方程式:__________________________。
(2)锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为_________(用化学式表示)。
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是_______________。
① 硫酸铝和氢氧化钠 ② 硫酸锌和氢氧化钠 ③硫酸铝和氨水 ④ 硫酸锌和氨水
(4)在火箭和导弹技术中,将铝粉与石墨、TiO2按一定比例混合均匀,涂在金属表面,在高温下煅烧,金属表面生成TiC和另一种耐高温的物质,写出该反应的化学方程式:__________。
(5)某混合物![]() ,含有
,含有![]() 、
、![]() 和
和![]() ,在一定条件下可实现如图所示的物质之间的变化:
,在一定条件下可实现如图所示的物质之间的变化:
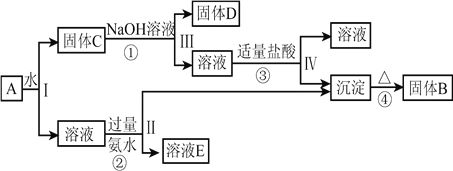
据此回答下列问题:
①写出固体![]() 的化学式:
的化学式: ![]() __________;
__________;
②写出D与稀硫酸反应的化学方程式:___________________________________________;
写出反应①的离子方程式:_________________________________________。
【答案】 2Al+2NaOH+2H2O=2NaAlO2+3H2↑ Na2ZnO2 ①②④ 4Al+3C+3TiO2![]() 2Al2O3+3TiC Al2O3 Fe2O3+ 3H2SO4
2Al2O3+3TiC Al2O3 Fe2O3+ 3H2SO4![]() Fe 2(SO4) 3+ 3H2O Al2O3 + 2OH
Fe 2(SO4) 3+ 3H2O Al2O3 + 2OH ![]() 2AlO2+ H2O
2AlO2+ H2O
【解析】(1)单质铝与氢氧化钠溶液反应生成偏氯酸钠和氢气,反应的方程式为2Al+2NaOH+2H2O=2NaAlO2+3H2↑。(2)迁移铝与氢氧化钠溶液的反应写出锌和氢氧化钠溶液反应的化学方程式为Zn + 2NaOH=Na2ZnO2+H2↑,所以锌和氢氧化钠溶液反应后,溶液中锌元素的存在形式为Na2ZnO2。(3)① 将硫酸铝溶液逐滴加入氢氧化钠溶液至过量,一开始不产生沉淀,最终生成氢氧化铝沉淀;将氢氧化钠溶液逐滴加入硫酸铝溶液中先生成白色沉淀,氢氧化钠过量后氢氧化铝后消失。可以鉴别。②将硫酸锌溶液逐滴加入氢氧化钠溶液至过量,一开始不产生沉淀,最终生成氢氧化铝沉淀;将氢氧化钠溶液逐滴加入硫酸锌溶液中先生成白色沉淀,氢氧化钠过量后氢氧化锌后消失。可以鉴别。③硫酸铝和氨水,无论滴加顺序如何,均生成氢氧化铝白色沉淀,无法鉴别。④将硫酸锌溶液逐滴加入氨水中至过量,一开始不产生沉淀,最终生成氢氧化铝沉淀;将氨水逐滴加入硫酸锌溶液中先生成白色沉淀氢氧化锌后消失。可以鉴别。选①②④。(4)根据信息知铝粉与石墨、TiO2在高温下反应生成TiC和Al2O3,该反应的化学方程式为4Al+3C+3TiO2![]() 2Al2O3+3TiC。(5)将混合物A溶于水,过滤,溶液为硫酸铝钾溶液,固体C为氧化铁和氧化铝的混合物,加入氢氧化钠溶液,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,固体D为氧化铁,向偏铝酸钠溶液中加入适量盐酸,二者发生反应生成氢氧化铝沉淀和氯化钠,氢氧化铝受热分解生成氧化铝和水,固体B为氧化铝;向硫酸铝钾溶液加入过量氨水,生成氢氧化铝沉淀和硫酸钾、硫酸铝的混合液,则①固体B为Al2O3;②D为氧化铁,氧化铁与稀硫酸反应生成硫酸铁和水,化学方程式为Fe2O3+ 3H2SO4=Fe 2(SO4) 3+ 3H2O;氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3 + 2OH =2AlO2+ H2O。
2Al2O3+3TiC。(5)将混合物A溶于水,过滤,溶液为硫酸铝钾溶液,固体C为氧化铁和氧化铝的混合物,加入氢氧化钠溶液,氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,固体D为氧化铁,向偏铝酸钠溶液中加入适量盐酸,二者发生反应生成氢氧化铝沉淀和氯化钠,氢氧化铝受热分解生成氧化铝和水,固体B为氧化铝;向硫酸铝钾溶液加入过量氨水,生成氢氧化铝沉淀和硫酸钾、硫酸铝的混合液,则①固体B为Al2O3;②D为氧化铁,氧化铁与稀硫酸反应生成硫酸铁和水,化学方程式为Fe2O3+ 3H2SO4=Fe 2(SO4) 3+ 3H2O;氧化铝和氢氧化钠溶液反应生成偏铝酸钠和水,离子方程式为Al2O3 + 2OH =2AlO2+ H2O。


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
【题目】如图表示有关物质之间的转化关系,A,C,E,G为非金属单质,其中A,G常温常压下为气态,E遇淀粉变蓝,K是一种常用食品添加剂,L是常见的无色无味液体,I为淡黄色固体,J的焰色反应呈浅紫色(透过蓝色钴玻璃). 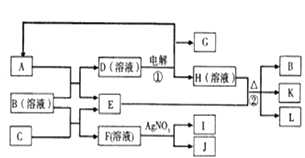
(1)B,I代表的物质化学式分别为、 .
(2)写出反应①②的离子方程式:
①
②
(3)选出实验室保存C单质的注意事项(A.无色瓶B.棕色瓶C.橡胶塞D.玻璃塞),除此之外还采取了什么特殊保存方法: .
(4)已知A,C,E均能与G反应,按其反应条件要求由高到低顺序为(用化学式表示)
(5)A与H溶液反应,其氧化产物和还原产物的物质的量的比为1:1,写出此反应的化学反应方程式: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X2+Y2 ==2XY是放热反应,则下列各组物质中,能量最高的是( )
A. 1mol X2与1 mol Y2 B. 2 mol XY C. 1 mol X2 D. 1 mol Y2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】寿山石的主要成分为叶腊石,其组成为Al2O34SiO2H2O,可以表示为Al2Si4Ox(OH)y。其中x、y的数值分别是( )
A. 10、2 B. 6、4 C. 8、2 D. 2、8
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】子琛做“将浓硫酸滴到一块小布上”的实验,发现生成的炭上冒“白烟”,推测炭能与浓硫酸反应.欲探究其生成物成分,通过简单分析及实验确定无H2和O2 , 因此继续进行如下探究.【查阅资料】①SO3能被浓硫酸及水吸收
②SO2性质:能使品红褪色,能被高锰酸钾溶液吸收,能使澄清石灰水变浑浊
③CO可与PdCl2溶液反应:PdCl2+CO+H2O═Pd(黑)↓+2HCl+CO2;不与KMnO4溶液反应
【提出猜想】生成物的成分可能为ⅠH2O、CO、SO2ⅡH2O、CO2、SO2ⅢH2O、CO、CO2、SO2
【实验验证】子琛设计了如下实验: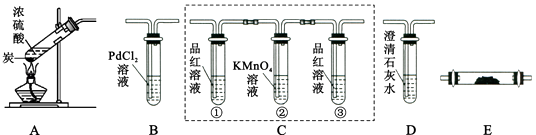
(1)【分析讨论】①请根据实验目的,按气流从左到右的方向将实验仪器组装完整:
A→→→D→ .
②装置E中所加药品是 , 作用是 .
③装置C中②的作用是除去SO2气体,则③试管中品红溶液的作用是 .
④若D中澄清石灰水变浑浊,方程式为 .
⑤实验结束冷却后,从实验安全角度考虑,清洗装置A中试管时不能直接向其中加水冲洗,原因是 .
(2)【实验结论】实验观察到的部分现象是:B中未见黑色沉淀,则猜想正确,写出炭与浓硫酸在加热条件下反应的化学方程式 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向100g CuSO4与H2SO4的混合溶液中加入质量分数为20%的氢氧化钠溶液,产生沉淀的质量与所加氢氧化钠溶液的质量关系如图所示,回答下列问题:
(1)由图象可知,NaOH先与混合溶液中发生反应.
(2)生成沉淀Cu(OH)2的质量是多少?
(3)当加入NaOH溶液的质量为40 g时,所得溶液中Na2SO4的质量分数是多少?(结果精确到0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是A、B、C、D四种粒子的结构示意图.E是硒元素在元素周期表中的信息,请回答下列问题: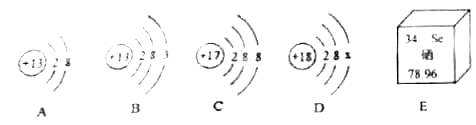
(1)图中A,B,C,D四种粒子中属于同种元素的是(填字母).
(2)D中x=;
(3)A,B,C,D四种粒子中具有稳定结构的原子是(填字母).
(4)E中硒元素的相对原子质量是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2013年2月,俄罗斯境内有大量陨石坠落,经化学分析,陨石中游离态的铁含量约为10%,此外还有橄榄石(Fe2SiO4)、亚硫酸盐等成分,下列有关说法正确的是
A. 此陨石是一种纯度较高的硅酸盐矿石
B. 此陨石具有耐酸碱的特性
C. 陨石中含有游离态的铁是因为在外太空中铁的活性比地球上铁的活性低
D. 橄榄石中Fe为+2价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 硅是半导体材料,可制造光导纤维
B. 水泥、玻璃、陶瓷是硅酸盐材料,它们是三大传统无机非金属材料
C. 水玻璃可用作木材防火剂
D. 石棉CaMg3Si4O12是种结构复杂的硅酸盐,通常用氧化物的形式表示为CaO·3MgO·4SiO2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com