
在标准状况下将1.92 g铜粉投入一定量浓HNO3中,随着铜粉的溶解,反应生成的气体颜色逐渐变浅,当铜粉完全溶解后共收集到由NO2和NO组成的混合气体1.12 L,则反应消耗HNO3的物质的量为 ( )。
A.0.8 mol B.0.6 mol
C.0.11 mol D.无法计算
 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
某稀溶液中含有Fe(NO3)3.Cu(NO3)2.HNO3,向其中逐渐加入铁粉,溶液中Fe2+的浓度(纵坐标)和加入铁粉的物质的量(横坐标)之间的关系入右图所示,则溶液中Fe(NO3)3.Cu(NO3)2.HNO3物质的量浓度之比为
A.1:1:1 B.1:3:1
C.3:3:8 D.1:1:4

查看答案和解析>>
科目:高中化学 来源: 题型:
,实验室合成环己烯的反应和实验装置如下:

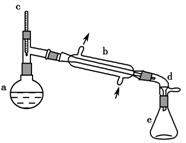
可能用到的有关数据如下:
| 相对分子质量 |
| 沸点/℃ | 溶解性 | |
| 环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20 g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1 mL浓硫酸。B中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90 ℃。
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5 %碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙。最终通过蒸馏得到纯净环己烯10 g。
回答下列问题:
(1)装置b的名称是________________。
(2)加入碎瓷片的作用是______________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是______(填正确答案标号)。
A.立即补加 B.冷却后补加
C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________。
(4)分液漏斗在使用前须清洗干净并________;在本实验分离过程中,产物应该从分液漏斗的________(填“上口倒出”或“下口放出”)。
(5)分离提纯过程中加入无水氯化钙的目的是________________。
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有________(填正确答案标号)。
A.圆底烧瓶 B.温度计 C.吸滤瓶 D.球形冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号)。
A.41% B.50%
C.61% D.70%
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关硫元素及其化合物的说法或描述正确的是 ( )。
A.由硫黄制备硫酸经历两步:S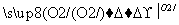 SO3
SO3 H2SO4
H2SO4
B.酸雨与土壤中的金属氧化物反应后,硫元素以单质的形式进入土壤中
C.在燃煤中加入石灰石可减少SO2排放,发生的反应为2CaCO3+2SO2+O2 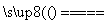 2CO2+2CaSO4
2CO2+2CaSO4
D.土壤中的闪锌矿(ZnS)遇到硫酸铜溶液转化为铜蓝(CuS),说明CuS很稳定,不具有还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
二氧化硫是重要的工业原料,探究其制备方法和性质具有非常重要的意义。
(1)工业上用黄铁矿(FeS2,其中硫元素为-1价)在高温下和氧气反应制备SO2:4FeS2+11O2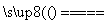 8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
8SO2+2Fe2O3,该反应中被氧化的元素是________(填元素符号)。当该反应转移2.75 mol电子时,生成的二氧化硫在标准状况下的体积为________ L。
(2)实验室中用下列装置测定SO2催化氧化为SO3的转化率。(已知SO3的熔点为16.8 ℃,假设气体进入装置时分别被完全吸收,且忽略空气中CO2的影响)
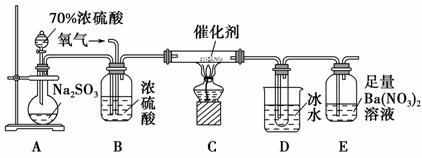
①简述使用分液漏斗向圆底烧瓶中滴加浓硫酸的操作:________________________________________。
②实验过程中,需要通入氧气。试写出一个用如下图所示装置制取氧气的化学方程式:______________________________________。

③当停止通入SO2,熄灭酒精灯后,需要继续通一段时间的氧气,其目的是___________________________________________________________。
④实验结束后,若装置D增加的质量为m g,装置E中产生白色沉淀的质量为n g,则此条件下二氧化硫的转化率是________(用含字母的代数式表示,不用化简)。
(3)某学习小组设计用如图装置验证二氧化硫的化学性质。
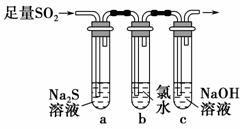
①能说明二氧化硫具有氧化性的实验现象为_______________________ ________________________________________________________。
②为验证二氧化硫的还原性,充分反应后,取试管b中的溶液分成三份,分别进行如下实验。
方案Ⅰ:向第一份溶液中加入AgNO3溶液,有白色沉淀生成
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去
方案Ⅲ:向第三份溶液中加入BaCl2溶液,产生白色沉淀
上述方案中合理的是________(填“Ⅰ”、“Ⅱ”或“Ⅲ”);试管b中发生反应的离子方程式为____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学利用如图所示装置进行实验,一段时间后,水沿导管缓慢上升。下列说法错误的是 ( )。
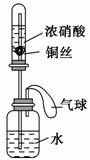
A.实验过程中气球体积会发生变化
B.广口瓶中液体的pH减小
C.广口瓶中有化合反应发生
D.试管中不可能发生分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
已知乙烯分子是平面结构,因此1,2二氯乙烯可形成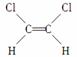 和
和 两种不同的空间异构体,称为顺反异构。下列能形成类似上述两种空间异构体的是( )
两种不同的空间异构体,称为顺反异构。下列能形成类似上述两种空间异构体的是( )
A.1丁烯 B.2甲基1丙烯 C.2丁烯 D.1丙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)水中的重金属污染物主要包括 、 、 、 等,它们能在生物体内 ,不易排出体外,故危害很大。水中的重金属污染物可以通过水中的 ,浓度逐级加大,而人正处于 ,通过食物或饮水,将这些重金属摄入体内,引起人体急性或慢性中毒。
(2)写出水中的无机汞(如HgCl2)在微生物作用下转化为甲基氯化汞的化
学方程式________________________________________________________。
蛋白质水解的产物NH3在微生物作用下,进一步氧化为 ,进而氧化
为 ,其过程用化学方程式表示为 ,
________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com