
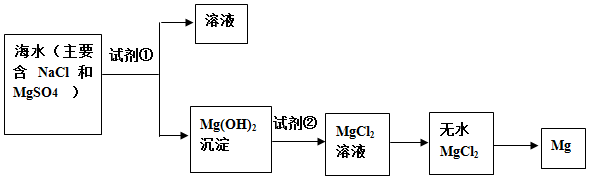
分析 (一)(1)在浓缩后的海水中加入碱可生成氢氧化镁;
(2)在浓缩后的海水中加入碱可生成氢氧化镁,然后加入盐酸生成氯化镁,电解熔融的氯化镁可得到镁;
(二) 根据海水中镁离子的浓度以及海水处理的成本进行对比分析,可得出结论.
解答 解:(一)(1)加入试剂①反应生成氢氧化镁,剩余溶液,最好使用氢氧化钠,既生成氢氧化镁又不在剩余溶液中引入其他杂质离子.
故答案为:NaOH;
(2)要使氢氧化镁转化为氯化镁,则需要加入盐酸反应,即试剂②是盐酸,工业上由无水MgCl2制取镁,常用电解的方法,方程式为MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑,
故答案为:HCl;MgCl2(熔融)$\frac{\underline{\;电解\;}}{\;}$Mg+Cl2↑;
(二)学生1与其他观点相比,海水中镁离子浓度小,使用的沉淀剂的量较大,且不利于收集氢氧化镁,因此学生1的观点不正确,原因是:海水中镁离子浓度小,沉淀剂的用量大,不利于镁离子的沉淀.
学生2与其他观点相比,高温蒸发海水,消耗的能源多,成本太高.因此学生2的观点不正确,原因是:能源消耗大,海水的综合利用低,成本高.
学生3与学生2相比,利用晒盐后的苦卤,节约能源,成本低;与学生1相比镁离子浓度高,有利于镁元素的富集.因此学生3的观点最好,因为:Mg2+浓度大,节约能源,成本较低.
故答案为:学生3的观点;该方法Mg2+浓度大,节约能源,成本较低.
点评 本题以海水的综合应用为载体综合考查物质的分离与提纯,侧重于考查学生化学知识的综合运用能力和评价能力,答题时注意从题目物质转化、化学反应、方法的优劣等来分考问题,通过本题要学会怎样评价不同方法的优劣,从而选择出最佳方法,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
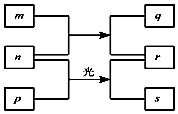 短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增加.m、p、r是由这些元素组成的二元化合物.n是元素Z的单质.通常为黄绿色气体,q的水溶液具有漂白性.0.01mol/L r溶液的pH为2,p是甲烷.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 原子半径的大小W<X<Y | |
| B. | 元素的非金属性Z>X>Y | |
| C. | Y的氢化物常温常压下为气态 | |
| D. | X的最高价氧化物对应的水化物为弱酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 当a≥b时,发生的离子反应为SO32-+Cl2+H2O=SO42-+2H++2Cl- | |
| B. | 当5a=4b时,发生的离子反应为SO32-+2I-+5Cl2+4H2O=4SO42-+I2+8H++10Cl- | |
| C. | 当a≤b≤$\frac{3}{2}$a时,反应中转移电子的物质的量n(e-)为amol≤n(e-)≤3amol | |
| D. | 当a<b<$\frac{3}{2}$a时,溶液中SO42-、I-与Cl-的物质的量之比为a:(3a-2b):2b |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属元素在不同化合物中的化合价均不同 | |
| B. | 金属一定具有良好的导电性、导热性和延展性 | |
| C. | 金属单质在化学反应中化合价一定升高,作还原剂 | |
| D. | 常温下,所有金属都能与酸反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
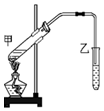 某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空:
某学习小组为探究乙醇与乙酸的酯化反应,在试管甲中加入3ml乙醇,然后边振荡试管边慢慢加入2ml浓硫酸和2ml乙酸;按如图连接好装置,用酒精灯缓慢加热,将产生的蒸气经导管通到乙试管内的液面上.按要求填空:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
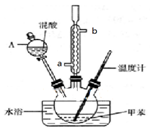 某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):
某实验小组用如图所示装置制备一硝基甲苯(包括对硝基甲苯和邻硝基甲苯):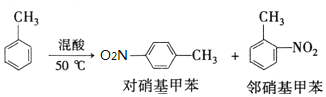
| 密度/g•cm-3 | 沸点/℃ | 溶解性 | |
| 甲苯 | 0.866 | 110.6 | 不溶于水,易溶于硝基甲苯 |
| 对硝基甲苯 | 1.286 | 237.7 | 不溶于水,易溶于液态烃 |
| 邻硝基甲苯 | 1.162 | 222 | 不溶于水,易溶于液态烃 |

查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属阳离子的氧化性:Y>X | |
| B. | X、Y用导线连接后插入浓硝酸中,X溶解 | |
| C. | X、Y用导线连接后插人稀盐酸中,Y的表面有气泡产生 | |
| D. | X、Y用导线连接后插入氢氧化钠溶液中,X极为电子流出的一极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com