
| A. | 可生成H2的质量为0.02g | |
| B. | 可生成氢的原子数为1.204×1023个 | |
| C. | 可生成O2的体积为0.224 L | |
| D. | 生成H2的量理论上等于0.02mol Zn与足量盐酸反应产生H2的量 |
分析 根据方程式2H2O=2H2↑+O2↑,光解0.02 mol水,可产生0.02 mol H2和0.01 mol O2,结合n=$\frac{m}{M}$=$\frac{V}{Vm}$=$\frac{N}{N{\;}_{A}}$结合物质的构成解答该题.
解答 解:根据方程式2H2O=2H2↑+O2↑,光解0.02 mol水,可产生0.02 mol H2和0.01 mol O2.则可得:
A.可生成H2的质量为0.02mol×2g/mol=0.04g,故A错误;
B.可生成氢的原子数为0.02mol×2×6.02×1023/mol=2.408×1022个,故B错误;
C.气体状况未知,无法计算氧气的体积,故C错误;
D.0.02mol Zn与足量盐酸反应生成0.02mol氢气,故D正确;
故选:D.
点评 本题考查物质的量的计算,侧重于学生的分析、计算能力的考查,难度不大,注意把握相关物理量的计算公式的运用以及物质的构成特点,把握相关反应,难度不大.


科目:高中化学 来源: 题型:选择题
| W | |||
| Y | Z | V |
| A. | W有多种同素异形体,且均具有高熔点、高沸点的性质 | |
| B. | Z的第一电离能小于V的第一电离能 | |
| C. | Y、Z与X的常见稳定液态氧化物反应的剧烈程度Y大于Z | |
| D. | X的离子半径一定小于与Y同族的短周期元素的离子半径 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 氯气通入水中:Cl2+H2O═H++Cl-+HClO | |
| B. | 往AlCl3溶液中滴加稀NH3•H2O:Al3++4NH3•H2O═AlO2-+4NH4++2H2O | |
| C. | Na2O2投入水中:2O22-+2H2O═4OH-+O2↑ | |
| D. | 向NaHCO3溶液中加过量Ca(OH)2溶液:Ca2++HCO3-+OH-═CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和 NaCl液和 CuSO4 溶液 | 均有固体析出 | 蛋白质均发生变性 |
| B | 向溶液 X 中 先 滴 加 稀 硝 酸,再 滴 加Ba(NO3)2 溶液 | 出现白色沉淀 | 溶液 X 中不一定含有 SO42- |
| C | 灼烧白色粉末 | 火焰呈黄色 | 证明原粉末中有 Na +,无 K+ |
| D | 将溴水加入苯中 | 溴水颜色变浅 | 苯与溴水发生取代反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
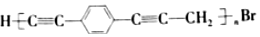 .下列说法正确的是( )
.下列说法正确的是( )| A. | 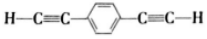 和苯乙炔互为同系物 和苯乙炔互为同系物 | |
| B. | 炔烃和卤代烃在一定条件下可发生取代反应 | |
| C. | 高分子材料P不指使溴的四氯化碳溶液褪色 | |
| D. | 生成P的单体是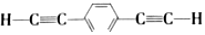 和CH3Br 和CH3Br |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤⑥ | B. | ②③④⑤ | C. | ②③④ | D. | ①③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com