
【题目】按照一定标准,根据物质与水反应的不同情况,对下列物质进行分类,如图所示,请填空:
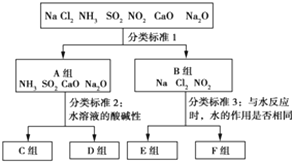
(1)上图中分类标准1(分成A、B组的依据)为_________________________________。
(2)工业上常用D组中________________(填化学式),来消除C组中物质对大气的污染,该反应的化学方程式为_____________________________________________。
(3)实验室由Al3+制备Al(OH)3时,应选择D组中________(填化学式)的水溶液,离子方程式为__________________________。
(4)F组中有两种物质,在工业上均有重要的用途,请各写出一个化学方程式表示其用途: ________________________________;________________________________________。
【答案】 是否与水发生氧化还原反应 CaO SO2+CaO===CaSO3、2CaSO3+O2===2CaSO4 NH3 Al3++3NH3·H2O===Al(OH)3↓+3NH![]() 2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O 3NO2+H2O===2HNO3+NO(其他合理答案均可)
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O 3NO2+H2O===2HNO3+NO(其他合理答案均可)
【解析】(1)溶于水分成AB两组的依据,分析反应过程可知,NH3、Na2O、SO2、CaO溶于水发生化合反应生成对应酸或碱,是非氧化还原反应;Cl2、Na、NO2,溶于水反应发生的是氧化还原反应,所以依据是是否与水发生氧化还原反应;(2)A组中的根据水溶液的酸碱性可以分为:溶液显酸性:SO2;溶液显碱性:NH3、CaO、Na2O;对空气有污染的是SO2,而通常选用CaO来消除SO2对空气的污染,反应为:SO2+CaO=CaSO3、2CaSO3+O2=2CaSO4;(3)Al(OH)3易溶于强碱,不溶于氨水,故实验室由Al3+制备Al(OH)3时,应选用D组中的氨水,反应为:Al3++3NH3·H2O=Al(OH)3↓+3NH4+;(4)钠与水的反应中,水做氧化剂;氯气、NO2与水的反应中,水既不做氧化剂也不做还原剂,故F组的物质为Cl2和NO2,Cl2的用途是制取漂白粉:2Cl2+2Ca(OH)2=Ca(ClO)2+CaCl2+2H2O,二氧化氮溶于水制备硝酸:3NO2+H2O=2HNO3+NO。


科目:高中化学 来源: 题型:
【题目】若NA为阿伏加德罗常数,已知某元素的阴离子Rn﹣的原子核中,中子数为A﹣x+n,其中A为原子的质量数,则m g Rn﹣中电子总数为( )
A.![]()
B.![]()
C.![]()
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】立方烷( ![]() )具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线:
)具有高度对称性、高致密性、高张力能及高稳定性等特点,因此合成立方烷及其衍生物成为化学界关注的热点.下面是立方烷衍生物I的一种合成路线: 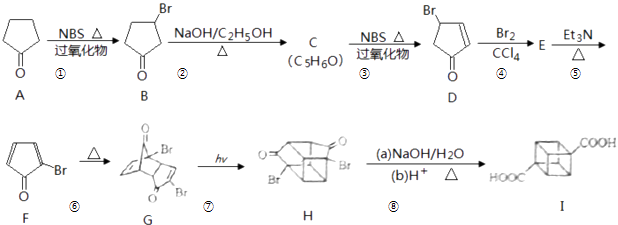
回答下列问题:
(1)C的结构简式为 , E的结构简式为 .
(2)③的反应类型为 , ⑤的反应类型为 .
(3)化合物A可由环戊烷经三步反应合成:![]()
反应I的试剂与条件为,反应2的化学方程式为 , 反应3可用的试剂为 .
(4)在I的合成路线中,互为同分异构体的化合物是 . (填化合物代号)
(5)I与碱石灰共热可化为立方烷.立方烷的核磁共振氢谱中有个峰.
(6)立方烷经硝化可得到六硝基立方烷,其可能的结构有种.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列与金属腐蚀有关的说法,正确的是( ) 
A.图1中,插入海水中的铁棒,越靠近底端腐蚀越严重
B.图2中,滴加少量K3[Fe(CN)6]溶液,没有蓝色沉淀出现
C.图3中,燃气灶的中心部位容易生锈,主要是由于高温下铁发生化学腐蚀
D.图4中,用牺牲镁块的方法来防止地下钢铁管道的腐蚀,镁块相当于原电池的正极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2003年,全国发生了严重的非典型肺炎疫情,消毒液一时成为抢购商品。“84”消毒液是市售主力军,其商标注明:①本品为无色液体,呈碱性,②使用时加水稀释,③可对餐具、衣物消毒,可漂白浅色衣物。其有效成分是()。
A.CH3CH2OH
B.KMnO4
C.NaClO
D.C6H5OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中,不正确的是( )
A. 金属钠在用小刀切割后,剩余的钠应放回煤油中
B. 容量瓶使用前需要检漏
C. 胶头滴管滴加液体时一般是悬在容器上口中部
D. 用托盘天平及称量纸称量4.20 g 烧碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环己酮(如图1)是一种重要的化工原料,实验室常用下列原理和装置制备(部分夹持仪器未画出)(如图2):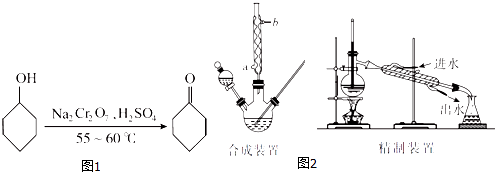
环己醇、环己酮和水的部分物理性质见下表(*括号中的数据表示该有机物与水形成的具有固定组成的混合物的沸点):
物质 | 相对分子质量 | 沸点(℃) | 密度(gcm﹣3 , 20℃) | 溶解性 |
环己醇 | 100 | 161.1(97.8) | 0.9624 | 能溶于水 |
环己酮 | 98 | 155.6(95) | 0.9478 | 微溶于水 |
水 | 18 | 100.0 | 0.9982 |
(1)已知合成环己酮的反应是放热反应,反应剧烈将导致体系温度迅速上升,副反应增多.实验时,先在合成装置中加入5.2 mL(5 g)环己醇和几粒沸石,再加入酸性Na2Cr2O7溶液.酸性Na2Cr2O7溶液的加料方式为(填代号).
A.一次性加入
B.缓慢加入
C.无所谓,怎样加入都可以
(2)若酸性Na2Cr2O7溶液的体积为35 mL,则应选取(填“100 mL”或“250mL”)的三颈瓶.
(3)反应完成后,加入适量水,蒸馏,收集95~100℃的馏分(设为A),其主要成分是的混合物.
(4)合成装置中冷凝管的作用是 , 冷凝水从冷凝管的(填“a”或“b”)口进入.
(5)在馏分A中加入氯化钠固体至饱和,振荡、静置、分液,得有机层(设为B).加入氯化钠固体的作用是 .
(6)在有机层B中加入无水硫酸镁固体,除去其中的少量水分.过滤,将滤液置于精制装置中蒸馏,收集(填代号)的馏分,得到纯净的环己酮.
A.100.0~102.0℃
B.154.0~156.0℃
C.160.0~162.0℃
(7)精制装置中的错误是 . (任写一点)
(8)若最终得到环己酮的质量为3.43 g,则环己酮的产率是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产生活中的作用发生了巨大改变。
(1)古代中国四大发明之一的指南针是由天然磁石制成的,其主要成分是(填字母序号)。
a.Fe b.FeO c.Fe3O4 d.Fe2O3
(2)硫酸渣的主要化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):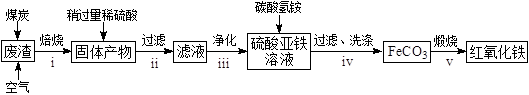
回答下列问题:
①在步骤i中产生的有毒气体可能有。
②在步骤iii操作中,要除去的离子之一为Al3+。若常温时Ksp[Al(OH)3]=1.0×1032 , 此时理论上将Al3+沉淀完全,则溶液的pH为。
③步骤iv中,生成FeCO3的离子方程式是。
(3)氯化铁溶液称为化学试剂中的“多面手”。向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生沉淀,写出该沉淀的化学式。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释。
(4)①古老而神奇的蓝色染料普鲁士蓝的合成方法如下:
复分解反应ii的离子方程式是。
②如今基于普鲁士蓝合成原理可检测食品中是否含CN , 方案如下:![]()
若试纸变蓝则证明食品中含有CN , 请解释检测时试纸中FeSO4的作用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(Lmin),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )
A.x:y=3:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0.4mol/L
D.A与B的平衡浓度之比为3:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com