
下列各组中两个化学反应,属于同一反应类型的一组是( )
A.由苯制溴苯;由乙醇与乙酸反应制乙酸乙酯
B.由乙烯制1,2﹣二溴乙烷;由乙烷制一氯乙烷
C.乙烯使溴水褪色;乙烯使酸性高锰酸钾溶液褪色
D.由苯制硝基苯;由苯制环己烷
科目:高中化学 来源:2015-2016学年河北省高二下期末化学试卷(解析版) 题型:选择题
现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江省高一下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.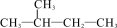 与
与 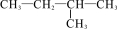 互为同分异构体
互为同分异构体
B.CH3—CH2—CH3、CH3—CH2—CH2—CH2—CH3、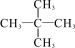 互为同系物,熔沸点逐渐升高
互为同系物,熔沸点逐渐升高
C.烷烃燃烧通式为:CnH2n+2+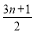 O2
O2 nCO2+(n+1)H2O
nCO2+(n+1)H2O
D.分子式为C4H10O并能与金属钠反应放出氢气的有机物有3种
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
下列描述中,不符合生产实际的是( )
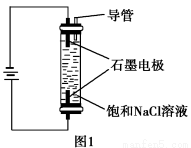
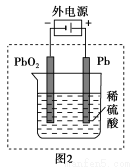
A.电解法精炼粗铜,用纯铜作阴极 
B.在镀件上电镀锌,用锌作阳极
C.用如图1装置可生产家用消毒液(NaClO)
D.用如图2装置为铅蓄电池充电
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
已知在1×105Pa,298 K条件下,1 g H2燃烧生成液态水放出142.9  kJ的热量,表示该反应的热化学方程式正确的是( )
kJ的热量,表示该反应的热化学方程式正确的是( )
A.2H2(g)+O2(g)===2H2O(l) ΔH=-142.9 kJ·mol-1
B.2H2(g)+O2(g)===2H2O (l) ΔH=-571.6 kJ·mol-1
(l) ΔH=-571.6 kJ·mol-1
C.2H2+O2===2H2O ΔH=-571.6 kJ·mol-1
D.H2(g)+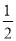 O2(g)===H2O(g) ΔH=-285.8 kJ·mol-1
O2(g)===H2O(g) ΔH=-285.8 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高一下期末化学试卷(解析版) 题型:选择题
下列说法正确的是( )
A.冰熔化时,分子中H﹣O键发生断裂
B.NaOH中只含有离子键
C.CO2与SiO2都属于分子晶体
D.熔沸点由高到低的顺序是金刚石>NaCl>I2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年海南省高一下期末化学试卷(解析版) 题型:填空题
1)现有如下两个反应:
A.NaOH + HCl = NaCl + H2O
B.2FeCl3 + Cu = 2FeCl2 + CuCl2
①根据两反应本质判断, 能设计成原电池(填“A”或“B”)。
②如果(A或B)不能,说明其原因 .
2)研究大气中含硫化合物(主要是SO2和H2S)的转化具有重要意义。
(1)高湿条件下,写出大气中SO2转化为HSO3-的方程式:_____________。
(2)土壤中的微生物可将大气中H2S经两步反应氧化成SO42-,两步反应的能量变化示意图如下:
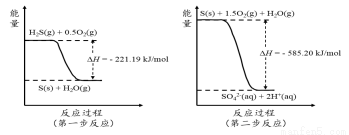
1mol H2S(g)全部氧化成SO42-(aq)的热化学方程式为______________________。
(3)二氧化硫—空气质子交换膜燃料电池可以利用大气所含SO2快速启动,其装置示意图如下:

质子的流动方向为___________(“从A到B”或“从B到A”)。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高一下期末化学试卷(解析版) 题型:计算题
将碳酸钠和碳酸氢钠的混合物27.4g,加热到质量不再变化时剩余物质的质量为21.2g。再另取试样27.4g,加入某浓度盐酸100ml,恰好完全反应。(书写计算过程,否则记零分)
(1)求混合物中Na2CO3和NaHCO3的质量。
(2)计算盐酸的物质的量浓度。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年西藏日喀则一中高二下学期期末化学试卷(解析版) 题型:实验题
硼镁泥是一种工业废料,主要成份是MgO(占40%),还有CaO、MnO、Fe2O3、FeO、Al2O3、SiO2等杂质.以硼镁泥为原料制取的硫酸镁,可用于印染、造纸、医药等工业.从硼镁泥中提取MgSO4•7H2O的流程如图:
根据题意回答下列问题:

(1)在酸解过程中,想加快酸解速率,请提出两种可行的措施________、________;
(2)滤渣的主要成份除含有Fe(OH)3、Al(OH)3、MnO2外,还有________;
(3)加入的NaClO可与Mn2+反应产生MnO2沉淀,该反应的离子方程式是________,在调节pH、发生水解之前,还有一种离子也会被NaClO氧化,该反应的离子方程式为________;
(4)如何检验滤液中Fe3+是否被除尽,简述检验操作________;
(5)已知MgSO4、CaSO4的溶解度如下表:
温度(℃) | 40 | 50 | 60 | 70 |
MgSO4 | 30.9 | 33.4 | 35.6 | 36.9 |
CaSO4 | 0.210 | 0.207 | 0.201 | 0.193 |
“除钙”是将MgSO4和CaSO4混合溶液中的CaSO4除去,根据上表数据,简要说明除钙的操作步骤________、________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com