
| 1×10 -14 |
| 5×10 -8 |
| ||
| 0.56 |
| 22.4 |
| 2.796 |
| 233 |
| 0.001 |
| 0.1 |
| 1×10 -14 |
| 5×10 -8 |
| ||
| 0.56 |
| 22.4 |
| 2.796 |
| 233 |
| 0.001 |
| 0.1 |


 王后雄学案教材完全解读系列答案
王后雄学案教材完全解读系列答案科目:高中化学 来源: 题型:
| A、生铁、不锈钢和黄铜都属于合金 |
| B、水泥、玻璃、陶瓷均属于无机非金属材料 |
| C、氧化钙、氧化镁、氧化铝都属于碱性氧化物 |
| D、溶液、胶体、浊液都属于分散系 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+、NH4+、I-、NO3- |
| B、Na+、Ca2+、ClO-、HCO3-、 |
| C、K+、Mg2+、CO32-、SO42- |
| D、Hg2+、H+、Cl-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ① |
| ② |
| ③ |
| ④ |
| 1 |
| 2 |
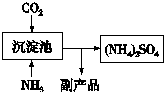
查看答案和解析>>
科目:高中化学 来源: 题型:
 短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:
短周期元素A、B、C、D、E,其中A、B、C、D在元素周期表中的位置如图所示,A、B、C原子的最外层电子数之和为17,E是短周期中原子半径最大的主族元素.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、溴水与碘化钾溶液:Br2+2I-=2Br-+I2 |
| B、钠与水:Na+H2O=Na++OH-+H2↑ |
| C、碳酸钙与稀盐酸:CO32-+2H+=CO2↑+H2O |
| D、硫酸铜溶液与氢氧化钡溶液:Cu2++2OH-=Cu(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na元素的相对原子质量 |
| B、S元素的相对原子质量 |
| C、O元素的相对原子质量 |
| D、Se元素各同位素的丰度 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间(s) n(mol) | 0 | 20 | 40 | 60 | 80 | 100 |
| n(NO2) | 0.00 | 0.48 | b | 1.04 | 1.2 | 1.2 |
| n(N2O4) | 0.80 | a | 0.40 | c | d | e |
| A、该反应的方程式为2NO2?N2O4 |
| B、80s前该反应一定没有达到平衡状态 |
| C、a的取值为0.56 |
| D、20s到40s内用N2O4表示的反应速率为0.010mol?L-1?S-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com